
Wetenschap
Wat is de dichtheid van waterstofgas?
Ideale gaswet:
De dichtheid van een ideaal gas kan worden berekend met behulp van de ideale gaswet:
* pv =nrt
Waar:
* p is de druk (in pascals of atmosferen)
* v is het volume (in kubieke meter of liters)
* n is het aantal mol van het gas
* r is de ideale gasconstante (8.314 j/mol · k of 0,0821 l · atm/mol · k)
* t is de temperatuur (in Kelvin)
Dichtheid afleiden:
Om dichtheid te krijgen (ρ =massa/volume), moeten we de ideale gaswet manipuleren:
1. n =m/m (waarbij m de massa van het gas is en m de molaire massa is)
2. Vervang n in de ideale gaswet: Pv =(m/m) rt
3. herschikken om op te lossen voor dichtheid (ρ =m/v): ρ =(PM)/(RT)
Dichtheid van waterstof bij standaardomstandigheden:
Bij standaardtemperatuur en druk (STP):
* t =273.15 K
* p =1 atm
* m (molaire massa van H₂) =2.016 g/mol
Deze waarden aansluiten op de vergelijking:
ρ =(1 atm * 2.016 g/mol)/(0,0821 l · atm/mol · k * 273.15 k)
ρ ≈ 0,0899 g/l
Belangrijke opmerking: De dichtheid van waterstofgas verandert aanzienlijk met temperatuur en druk. Bij hogere temperaturen en druk zal de dichtheid toenemen.
Laat het me weten als je de dichtheid van waterstof onder specifieke omstandigheden nodig hebt.
 Wat is het verschil tussen dihydrogen en waterstof?
Wat is het verschil tussen dihydrogen en waterstof?  Hoeveel atomen in 32 mol zwavel?
Hoeveel atomen in 32 mol zwavel?  Wat is de betekenis van het feit dat niets ijzer vernietigt behalve zijn eigen corrosie?
Wat is de betekenis van het feit dat niets ijzer vernietigt behalve zijn eigen corrosie?  Wat is de balans van silicium reageert met koolstofdioxide -vormcarbide en dioxide?
Wat is de balans van silicium reageert met koolstofdioxide -vormcarbide en dioxide?  Welk element is het meest reactieve uit nikkelchloorhelium en ijzer?
Welk element is het meest reactieve uit nikkelchloorhelium en ijzer?
 Hoe vormen wij mensen de aarde naast natuurlijke krachten?
Hoe vormen wij mensen de aarde naast natuurlijke krachten?  Hittegolf Zuid-Australië breekt recordtemperaturen
Hittegolf Zuid-Australië breekt recordtemperaturen Heilige bossen zijn veerkrachtig en tonen capaciteit voor hersteluitbreiding, zo blijkt uit een Grieks onderzoek
Heilige bossen zijn veerkrachtig en tonen capaciteit voor hersteluitbreiding, zo blijkt uit een Grieks onderzoek  The Ecosystems of Ghana
The Ecosystems of Ghana Onderzoek toont aan dat het opvoeren van koolstofafvang de sleutel kan zijn tot het verminderen van klimaatverandering
Onderzoek toont aan dat het opvoeren van koolstofafvang de sleutel kan zijn tot het verminderen van klimaatverandering
Hoofdlijnen
- Hoe verhouden de voorvoegsels van saccharide -woorden zich tot structuursuiker?
- Waarom wordt wetenschappelijke notatie gebruikt in de wetenschap?
- Hoeveel bases heeft een dubbele helix nadat de complementaire streng is toegevoegd?
- Hoe worden Laburnum -zaden verspreid?
- Hebben vissen last van zuurstofgebrek?
- In welk stadium van cellulaire ademhaling komen vetten -eiwitten en koolhydraten de metabolische route binnen?
- Onderzoekers beschrijven een belangrijk onderdeel in het energievoorzieningsmechanisme van het lichaam
- Welk deel van de celstructuur regelt replicatiechromosomen voorafgaand aan deling?
- Genen die samenkomen met verschillende allelen worden hoe genoemd?
- Moleculaire make-over maakt van slap antilichaam een SARS-CoV-2-tacker
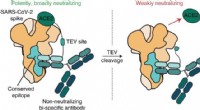
- Onderzoekers ontwikkelen verbeterd recyclingproces voor koolstofvezels

- Onderzoek geeft aan hoe algemene anesthetica en benzo's inwerken op receptoren in de hersenen
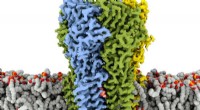
- Een duidelijk beeld schetsen van hoe stikstofoxiden worden gevormd

- Nieuw materiaal om traditionele reactiekatalysatoren voor zuurstofreductie te overtreffen

 Monitoring van COVID-19:kunnen medicijnen die in afvalwater worden aangetroffen een vroegtijdige waarschuwing geven?
Monitoring van COVID-19:kunnen medicijnen die in afvalwater worden aangetroffen een vroegtijdige waarschuwing geven?  Het is niet zo gemakkelijk om de ware maat der dingen te krijgen
Het is niet zo gemakkelijk om de ware maat der dingen te krijgen Wat betekent spanning in de wetenschap?
Wat betekent spanning in de wetenschap?  Oplosmiddelonderzoek lost puzzel op duurzaamheid van zonnecellen op
Oplosmiddelonderzoek lost puzzel op duurzaamheid van zonnecellen op Wat is de chemische groep zwarte onyx?
Wat is de chemische groep zwarte onyx?  Wat is de temperatuur van planetaire nevels?
Wat is de temperatuur van planetaire nevels?  Hoe ziet de aarde eruit vanaf Mars?
Hoe ziet de aarde eruit vanaf Mars?  U wilt stap voor stap de valentie van calciumfosfaat?
U wilt stap voor stap de valentie van calciumfosfaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

