
Wetenschap
Hoe verhoudt de tweede wet van de thermodynamica zich tot kristalvorming?
Hier is hoe de tweede wet van toepassing is:
* Entropie -toename in de omgeving: Terwijl een kristal ontstaat, laat het systeem warmte af aan de omgeving. Deze warmte verhoogt de entropie van de omgeving, die zwaarder weegt dan de afname van entropie in het kristal zelf. De netto verandering in entropie voor het hele systeem (Crystal + -omgeving) is positief en bevredigt de tweede wet.
* spontane kristallisatie: Het proces van kristalvorming is vaak spontaan omdat het leidt tot een lagere vrije energietoestand. Dit gebeurt door de afgifte van warmte tijdens kristallisatie, die de enthalpie (interne energie) van het systeem vermindert. De afname van enthalpie, in combinatie met de toename van de entropie van de omgeving, resulteert in een netto afname van Gibbs -vrije energie, waardoor kristallisatie thermodynamisch gunstig wordt.
* kristalgrootte en entropie: De entropieverandering geassocieerd met kristalvorming is afhankelijk van de grootte van het kristal. Kleinere kristallen hebben een hoger oppervlak tot volumeverhouding, wat leidt tot een grotere bijdrage van oppervlakte -entropie, die geassocieerd is met wanorde. Dit is de reden waarom grotere kristallen thermodynamisch stabieler zijn, omdat ze een lager oppervlak tot volumeverhouding hebben.
In wezen leidt kristalvorming tot een toename in volgorde binnen het kristal zelf, veroorzaakt het ook een toename van de aandoening in de omgeving. De algehele entropiewijziging voor het hele systeem blijft positief en houdt zich aan de tweede wet van de thermodynamica.
Bovendien wordt de vorming van kristallen vaak aangedreven door een vermindering van vrije energie, wat een gevolg is van de enthalpie -afname als gevolg van de afgifte van warmte en de entropie -toename in de omgeving.
 De planeet schade toebrengen is niet alleen slecht voor de mensheid, het kan slecht zijn voor de zaken
De planeet schade toebrengen is niet alleen slecht voor de mensheid, het kan slecht zijn voor de zaken Informerend beleid voor wereldwijde voedselzekerheid op lange termijn
Informerend beleid voor wereldwijde voedselzekerheid op lange termijn vulkanen, aardbevingen:brandt de Ring of Fire?
vulkanen, aardbevingen:brandt de Ring of Fire? Wat is de betekenis van het behoudsinformatierecht in de velddatawetenschap en -theorie?
Wat is de betekenis van het behoudsinformatierecht in de velddatawetenschap en -theorie?  Bushfire-kaarten van satellietgegevens tonen een flagrante kloof in de paraatheid van Australië
Bushfire-kaarten van satellietgegevens tonen een flagrante kloof in de paraatheid van Australië
Hoofdlijnen
- Wat is Feedback-inhibitie en waarom is het belangrijk bij het reguleren van de enzymactiviteit?
- Gaat het veranderen van de sequentie van nucleotiden altijd tot een verandering aminozuren?
- Nucleïnezuren: structuur, functie, typen en voorbeelden
- Inzicht in de verspreiding van gedrag:hoe langdurige verbindingen de snelheid van sociale besmetting versnellen
- Wat beschrijft iets dat is gemaakt uit wetenschappelijke gegevens om de samenleving ten goede te komen?
- Zuurstof is vereist in biologische systemen waarvoor?
- Waarom sommige koekoeken blauwe eieren leggen
- Waar worden pseudopodia en flagellum cillia voor gebruikt?
- Human Heart Science Projects
- COVID-ademtesten - zou het de volgende kunnen zijn? Onderzoek zegt ja

- Tijdmachine biedt nieuwe aanpak voor het testen van geneesmiddelen voor alvleesklierkanker

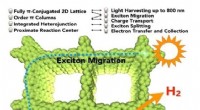
- Fotokatalytische waterstofproductie uit water
- Opkomst van mannelijke individuen in angelloze bijenkolonies leidt tot de dood van koninginnen

- Microbiële diefstal maakt afbraak van methaan mogelijk, giftige methylkwik
 Welke van de volgende gassen kan in de atmosfeer worden gevonden met een concentratie groter dan 1 procent?
Welke van de volgende gassen kan in de atmosfeer worden gevonden met een concentratie groter dan 1 procent?  Nieuwe theorie suggereert dat grote klodders materiaal in de aardmantel overblijfselen zijn van protoplaneet Theia
Nieuwe theorie suggereert dat grote klodders materiaal in de aardmantel overblijfselen zijn van protoplaneet Theia Wat zijn de obligatietypen van ICL3 N20 en licll uw keuzes zijn covalent ionisch metallic?
Wat zijn de obligatietypen van ICL3 N20 en licll uw keuzes zijn covalent ionisch metallic?  De digitale kloof:kleine, sociale programma's kunnen helpen om senioren online te krijgen
De digitale kloof:kleine, sociale programma's kunnen helpen om senioren online te krijgen Van lotion tot oceaanstomer
Van lotion tot oceaanstomer High School Biology Experiment Ideas
High School Biology Experiment Ideas Peter Higgs transformeerde wat we weten over de bouwstenen van het universum
Peter Higgs transformeerde wat we weten over de bouwstenen van het universum  Een geavanceerde slangenrobot voor rampgebieden klimt door op te rollen
Een geavanceerde slangenrobot voor rampgebieden klimt door op te rollen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

