
Wetenschap
Vormt broom een kation of anion?
Bromine vormt een anion .
Dit is waarom:
* elektronegativiteit: Bromine is een niet -metaal met een relatief hoge elektronegativiteit. Dit betekent dat het een sterke neiging heeft om elektronen aan te trekken.
* octetregel: Bromine moet één elektron krijgen om een stabiel octet (8 elektronen) in zijn buitenste schaal te bereiken.
* ionenvorming: Om deze stabiele configuratie te bereiken, accepteert Bromine gemakkelijk een elektron en vormt een negatief geladen ion genaamd een bromide -ion (Br⁻).
 Wat is de opgeloste stof en het oplosmiddel van kaliumnitraatoplossing?
Wat is de opgeloste stof en het oplosmiddel van kaliumnitraatoplossing?  Welk organisch molecuul wordt gevonden in het chromatine van cellen?
Welk organisch molecuul wordt gevonden in het chromatine van cellen?  Wat gebeurt er met de dichtheid van een gekoelde vloeistof?
Wat gebeurt er met de dichtheid van een gekoelde vloeistof?  Hoeveel milliliter zitten er in 100 g poeder?
Hoeveel milliliter zitten er in 100 g poeder?  Wat laat het periodiek systeem ons zien over atomen van verschillende elementen?
Wat laat het periodiek systeem ons zien over atomen van verschillende elementen?
 Antarctisch zee-ijs krimpt voor tweede jaar op rij
Antarctisch zee-ijs krimpt voor tweede jaar op rij Online calculator laat zien hoe bomen de luchtkwaliteit kunnen verbeteren en de gezondheidskosten kunnen verlagen
Online calculator laat zien hoe bomen de luchtkwaliteit kunnen verbeteren en de gezondheidskosten kunnen verlagen  Gravende krabben die kwelders hervormen, met klimaatverandering als schuld
Gravende krabben die kwelders hervormen, met klimaatverandering als schuld Typen bedreigde regenwoudplanten
Typen bedreigde regenwoudplanten Bescherming van koraalriffen in een verslechterende omgeving
Bescherming van koraalriffen in een verslechterende omgeving
Hoofdlijnen
- Waar wordt ATPase gevonden in de mitochondrion?
- Maken planten muziek?
- Wat is de studie van de evolutie van vertakkingspatronen?
- Indringende vraag:Wat is een neutrino?
- Welk deel van een streng -DNA vertelt de cel wat eiwit moet maken?
- 11. Aminozuren zijn essentiële bouwstenen in het menselijk lichaam. Macromoleculen worden door voedsel gehydrolyseerd tot aminozuren. Welke macromoleculen voorzien het lichaam van zurenA koolhydratenB vettenC eiwittenD suikers?
- Wat is een systeem dat extracellulaire vloeistof verzamelt en het aan uw lichaam terugbrengt?
- Welk kenmerk wordt genoemd als het celmembraan alleen bepaalde moleculen en ionen de cel binnenlaat of verlaat?
- Orkaan Ian Street Shark-video tart geloof
- Er worden nieuwe biologisch afbreekbare polyurethaanschuimen ontwikkeld van tarwestro

- Nieuwe technologie zet biomassa om in steenkool

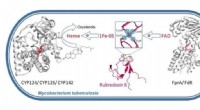
- Nieuwe studie verklaart Mycobacterium tuberculosis hoge weerstand tegen medicijnen en immuniteit
- Nieuwe bevindingen over het effect van Epsom-zout - Epsom-zoutreceptor geïdentificeerd
- Een nieuwe manier om methaan direct om te zetten in methanol met behulp van goud-palladium nanodeeltjes

 Evolueren dieren nog steeds?
Evolueren dieren nog steeds?  Natriumchloraat levert natriumchloride plus zuurstofgas op?
Natriumchloraat levert natriumchloride plus zuurstofgas op?  Welke mineralen maken zwavel?
Welke mineralen maken zwavel?  Wat zijn tye -namen van de sterren in Cygnus?
Wat zijn tye -namen van de sterren in Cygnus?  Duikt een persoon in water een voorbeeld van potentiële energie?
Duikt een persoon in water een voorbeeld van potentiële energie?  Wat voor soort energie schudt een rammelaar?
Wat voor soort energie schudt een rammelaar?  Wanneer verwarmde luchtmoleculen in een hete ballon al snel thermische energie naar de bovenkant van de ballon dragen?
Wanneer verwarmde luchtmoleculen in een hete ballon al snel thermische energie naar de bovenkant van de ballon dragen?  Light Wave-experimenten
Light Wave-experimenten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

