
Wetenschap
Wat voor soort krachten bestaan er tussen zuurstofmoleculen in vloeibare zuurstof?
Dit is waarom:
* Zuurstof is een niet -polair molecuul: Zuurstofmoleculen (O2) hebben een symmetrische structuur, dus hun elektronenverdeling is even. Dit betekent dat ze geen permanent dipoolmoment hebben.
* van der Waals krachten: Dit zijn zwakke, tijdelijke aantrekkelijke krachten die voortvloeien uit tijdelijke schommelingen in elektronenverdeling rond moleculen.
* Dispersietroepen in Londen: Dit zijn het zwakste type van der Waals -krachten. Ze komen voor als gevolg van tijdelijke, onmiddellijke dipolen die zich vormen in niet -polaire moleculen als elektronen zich rond het molecuul bewegen. Deze tijdelijke dipolen induceren dipolen in naburige moleculen, wat leidt tot zwakke attracties.
Waarom niet andere soorten krachten?
* waterstofbinding: Dit vereist een waterstofatoom dat is gebonden aan een sterk elektronegatief atoom zoals zuurstof, stikstof of fluor. Hoewel zuurstofmoleculen zuurstofatomen hebben, zijn ze niet direct gebonden aan waterstofatomen, dus waterstofbinding treft niet op.
* Dipole-dipole interacties: Deze treden op tussen polaire moleculen, wat zuurstof niet is.
Samenvattend zijn de krachten tussen zuurstofmoleculen in vloeibare zuurstof zwakke dispersiekrachten in Londen, als gevolg van tijdelijke fluctuaties in elektronenverdeling.
 Wat zijn de namen van vijf platonische vaste stoffen?
Wat zijn de namen van vijf platonische vaste stoffen?  Eenkristallen diamant klaar maken voor elektronica
Eenkristallen diamant klaar maken voor elektronica Leg de vorming uit van een ionische verbinding samengesteld cesium en fosfor?
Leg de vorming uit van een ionische verbinding samengesteld cesium en fosfor?  Hoeveel elektronen doneert één Adam van calcium aan atoomzuurstof tijdens de Formation Compound Cao?
Hoeveel elektronen doneert één Adam van calcium aan atoomzuurstof tijdens de Formation Compound Cao?  Zijn ijsblokjes in vloeibaar water homogeen?
Zijn ijsblokjes in vloeibaar water homogeen?
 Nieuwe studie heeft een andere benadering om menselijke activiteit aan te tonen die aardbevingen in Texas veroorzaakt
Nieuwe studie heeft een andere benadering om menselijke activiteit aan te tonen die aardbevingen in Texas veroorzaakt Kustveranderingen in Griekenland volgen
Kustveranderingen in Griekenland volgen NASA's GPM ziet tropische storm Hector zich vormen
NASA's GPM ziet tropische storm Hector zich vormen Hoe overleven herten het barre winterweer?
Hoe overleven herten het barre winterweer?  Het openen van plastic zakken en flessen kan microplastics genereren
Het openen van plastic zakken en flessen kan microplastics genereren
Hoofdlijnen
- Welke soorten cellen en organismen ondergaan mitose en meiose?
- Vrijlating van hagedissen brengt zeldzame soorten terug naar hun natuurlijke habitat in Groot-Brittannië
- Valse oogvlekken intimideren roofdieren, onderzoekers vinden
- Welke van deze patrouilleren het lichaam zoeken indringers vernietigen bacteriën en helpen bij immuniteit?
- Wat is de functie van microbiologie?
- Waarom zijn wortel haarcellen belangrijk voor planten?
- Wat voor soort cel komt uit mitotische divisie?
- Wat zal het genotype van een organisme bepalen?
- Wat maakt Bones moeilijk?
- Video:Waarom is de lucht aan de westkust oranje?

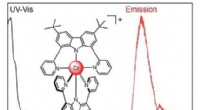
- Een nieuw chroomcomplex zendt licht uit in de ongrijpbare NIR-II-golflengte
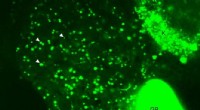
- Wetenschappers kijken naar vetmetabolisme in levende vissen, observeer real-time lipidenbiochemie
- Uit onderzoek blijkt dat elk haar van het menselijk lichaam kan worden gebruikt voor identificatie

- Een röntgenfoto maken van een atoombinding

 Welk metaal wordt het meest gebruikt als geleider?
Welk metaal wordt het meest gebruikt als geleider?  Lost koolstof op in disulfide?
Lost koolstof op in disulfide?  Hoe kunnen we de fotodegradatie van plastic versnellen?
Hoe kunnen we de fotodegradatie van plastic versnellen?  Tesla CEO laat de laatste bom vallen met een uitkoopvoorstel van $ 72 miljard
Tesla CEO laat de laatste bom vallen met een uitkoopvoorstel van $ 72 miljard Zijn er gletsjers op Fiji Island Mountains?
Zijn er gletsjers op Fiji Island Mountains?  Wat voor soort natuurkunde zijn er?
Wat voor soort natuurkunde zijn er?  Welk effect had de eerste maanlanding op de wereld?
Welk effect had de eerste maanlanding op de wereld?  Is natriumchloride een vloeistof bij kamertemperatuur?
Is natriumchloride een vloeistof bij kamertemperatuur?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

