
Wetenschap
Waarom lost zout op in heet water?
1. Verhoogde kinetische energie:
* moleculen bewegen sneller: Warmte biedt energie aan watermoleculen, waardoor ze sneller bewegen en intenser trilt. Deze verhoogde kinetische energie stelt hen in staat om de ionische bindingen uit elkaar te breken die het natrium (Na+) en chloride (Cl-) ionen in het zoutkristal vasthouden.
* Meer botsingen: De snellere beweging van watermoleculen resulteert in frequentere botsingen met het zoutkristal, waardoor de kansen op het verstoren van de ionische bindingen en het vrijgeven van ionen in oplossing worden vergroot.
2. Verhoogde polariteit:
* verzwakte waterstofbruggen: Terwijl water opwarmt, worden de waterstofbindingen tussen watermoleculen zwakker, waardoor ze gemakkelijker kunnen communiceren met de geladen ionen.
* Verbeterde solvatie: Deze verzwakking van waterstofbindingen verhoogt het vermogen van watermoleculen om de individuele Na+ en Clers te omringen en te isoleren, waardoor ze zich opnieuw in het zoutkristal kunnen vormen.
3. Verhoogde oplosbaarheid:
* Hogere oplosbaarheid: De oplosbaarheid van zout in water neemt toe met de temperatuur. Dit betekent dat bij hogere temperaturen water meer opgelost zout kan bevatten voordat ze verzadiging bereikt.
Samenvattend: Heet water biedt meer energie om de ionische bindingen in zoutkristallen te verstoren, wat leidt tot snellere oplossing en grotere oplosbaarheid. De verhoogde kinetische energie van watermoleculen, samen met de verzwakte waterstofbruggen, verbeteren het vermogen van water om de ionen te oplossen en in oplossing te houden.
 Experimenten en analyses laten zien hoe elektronen en protonen samenkomen op een elektrodeoppervlak
Experimenten en analyses laten zien hoe elektronen en protonen samenkomen op een elektrodeoppervlak Een anorganische verbinding wanneer in water wordt geplaatst, dissocieert 99 procent die waterstofionen en anionen vormt, wat zou deze stof zijn?
Een anorganische verbinding wanneer in water wordt geplaatst, dissocieert 99 procent die waterstofionen en anionen vormt, wat zou deze stof zijn?  Wat is een anorganische rots?
Wat is een anorganische rots?  Sterke M-M Pauli-afstoting leidt tot weerzinwekkende metalophiliciteit
Sterke M-M Pauli-afstoting leidt tot weerzinwekkende metalophiliciteit Krakende ontdekking:Japanse wetenschapper gebruikt eiwit voor schone energie
Krakende ontdekking:Japanse wetenschapper gebruikt eiwit voor schone energie
Hoofdlijnen
- Grafische Australische video van Japanse walvisvangst vrijgegeven
- Hoe huilen werkt
- Honingbijen steken minder snel in grotere groepen
- Wat is innovatie, en hoe kunnen we de sluimerende eigenschappen ervan wakker schudden en cultiveren?
- Adenosine trifosfaat (ATP): definitie, structuur en functie
- Hoe zijn bacteriën betrokken bij de vorming van steenkool?
- Wat is de enige manier waarop een recessieve eigenschap tot uiting komt?
- Een enzym dat de vorming van het DNA katalyseert Molecuul
- Welke chromosomen worden gevonden in een dochtercel?
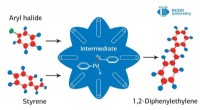
- Nieuwe katalysator verbetert koolstofdioxide tot gevonden brandstoffen
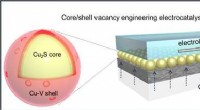
- Chemicus ontwikkelt bloemachtige katalysatoren uit grafeen
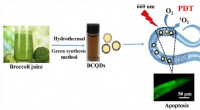
- Eenvoudig en high-throughput model voor het evalueren van de efficiëntie van fotodynamische agent
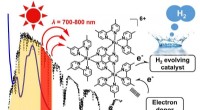
- NIR-gestuurde H2-evolutie uit water:uitbreidend golflengtebereik voor omzetting van zonne-energie
- Ecologische energie-accu gemaakt van vanilline

 Wat zijn enkele beelden van de put en de slinger?
Wat zijn enkele beelden van de put en de slinger?  Welk blad bevat meer chlorofyl, donkergroen of licht? Is dit een strikvraag?
Welk blad bevat meer chlorofyl, donkergroen of licht? Is dit een strikvraag?  Brits onderzoek naar Amazon-investering toont hardere aanpak
Brits onderzoek naar Amazon-investering toont hardere aanpak Geheugen, depressie, slapeloosheid - en wormen?
Geheugen, depressie, slapeloosheid - en wormen?  Is het moedergesteente het grootste bestanddeel van de bodem?
Is het moedergesteente het grootste bestanddeel van de bodem?  Vaste condensatie op een oppervlak dat lager is dan 0c bekend als?
Vaste condensatie op een oppervlak dat lager is dan 0c bekend als?  Welke chemicus studeren elementen?
Welke chemicus studeren elementen?  Uitbreiding van wereldwijde bossen weerspiegelt welzijn, geen stijgende CO2, deskundigen zeggen
Uitbreiding van wereldwijde bossen weerspiegelt welzijn, geen stijgende CO2, deskundigen zeggen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

