
Wetenschap
Welk metaal is de meest gemakkelijk geoxideerde van alle elementen?
Dit is waarom:
* Elektrochemische serie: Lithium zit helemaal bovenaan de elektrochemische serie, die elementen rangschikt op basis van hun neiging om elektronen te verliezen (oxideren). Hoe hoger het element op de serie zit, hoe gemakkelijker het oxideert.
* Lage ionisatie -energie: Lithium heeft een zeer lage ionisatie -energie, wat betekent dat het heel weinig energie kost om een elektron uit het atoom te verwijderen. Dit maakt het zeer vatbaar voor oxidatie.
* Hoge reactiviteit: Lithium is extreem reactief met lucht en water en vormt respectievelijk gemakkelijk lithiumoxide (li₂o) en lithiumhydroxide (LIOH).
Belangrijke opmerking: Hoewel lithium het meest gemakkelijk geoxideerde metaal is, is het cruciaal om te onthouden dat andere metalen ook onder specifieke omstandigheden kunnen worden geoxideerd.
 Toegenomen smeltende sneeuw in de winter bedreigt westerse watervoorraden
Toegenomen smeltende sneeuw in de winter bedreigt westerse watervoorraden De meest invloedrijke klimaatwetenschappelijke paper aller tijden
De meest invloedrijke klimaatwetenschappelijke paper aller tijden Wanneer is een zonlicht of lucht zeewater niet gratis goed?
Wanneer is een zonlicht of lucht zeewater niet gratis goed?  Stijging in boskap in Zuidoost-Azië waardoor broeikasgassen toenemen
Stijging in boskap in Zuidoost-Azië waardoor broeikasgassen toenemen Aardbevingen in Indonesische provincie verwoest in december
Aardbevingen in Indonesische provincie verwoest in december
Hoofdlijnen
- Welke verklaring beschrijft het beste hoe wetenschappers milieu -DNA (EDNA) verkrijgen van karper in de waterwegen in de buurt van Chicago?
- Wat is de wetenschappelijke naam of taxonomische classificatie van plantengroonde gansefoot?
- Wat is een gespecialiseerde cellen die door schimmels en varens worden gebruikt voor reproductie?
- Wat is de structuur van stamcellen?
- Wat is TA Cloning?
- Waarom zijn fruitvliegjes een populair organisme voor het bestuderen van overerving?
- Hoe klimaatverandering de stikstofpoel in de padiebodem in het noordoosten van China beïnvloedt
- Animatie ontmoet biologie - werpt nieuw licht op het gedrag van dieren
- Wat wordt bedoeld met primitieve translationele vector?
- Door dik en dun:neutronen volgen lithiumionen in batterij-elektroden

- 3D-printen elektrisch ondersteund, op parelmoer geïnspireerde structuren met zelfgevoelige mogelijkheden
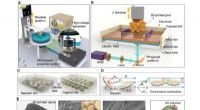
- Karakteriseringsstrategie helpt bij het scheiden van metaal met een hoge zuiverheid
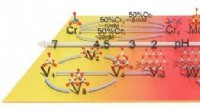
- Onderzoekers ontwikkelen tool om het gedrag van kunststoffen tot op moleculaire schaal te onderzoeken

- Onderzoek zou assemblagelijnsynthese van veelvoorkomende aminebevattende medicijnen mogelijk kunnen maken

 Het faseren van quantum-annealers in experimenten uit de niet-evenwichtsfysica
Het faseren van quantum-annealers in experimenten uit de niet-evenwichtsfysica Intracellulaire opnames met behulp van nanotoren-elektroden
Intracellulaire opnames met behulp van nanotoren-elektroden Wetenschappers synthetiseren analogen van stoffen die in geneesmiddelen worden gebruikt
Wetenschappers synthetiseren analogen van stoffen die in geneesmiddelen worden gebruikt Hoeveel centimeter is gelijk aan 12 centimeter?
Hoeveel centimeter is gelijk aan 12 centimeter?  In wat voor soort energie verandert potentieel in?
In wat voor soort energie verandert potentieel in?  Black Lives Matter in Europa:wat blijft er over van de beweging?
Black Lives Matter in Europa:wat blijft er over van de beweging? Eerste ruimtesonde om langs de maan te vliegen?
Eerste ruimtesonde om langs de maan te vliegen?  Waarom wordt het het zonnestelsel genoemd?
Waarom wordt het het zonnestelsel genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

