
Wetenschap
Waarom wordt benzeen geclassificeerd als een aromatische verbinding?
1. Cyclische structuur: Benzeen heeft een gesloten ring van zes koolstofatomen en vormt een cyclische structuur.
2. Vlakke geometrie: De zes koolstofatomen in benzeen liggen in hetzelfde vlak, waardoor het een vlakke structuur krijgt.
3. Gedelokaliseerde elektronen: Elk koolstofatoom in benzeen is SP 2 gehybridiseerd en een niet -gehybridiseerde P orbital achtergelaten. Deze P -orbitalen overlappen elkaar boven en onder het vlak van de ring en vormen een continu systeem van gedelokaliseerde PI -elektronen.
4. Huckels regel: Benzeen voldoet aan de heerschappij van Huckel, waarin staat dat een cyclisch, vlakke molecuul met een continue ring van gedelokaliseerde elektronen aromatisch zal zijn als het 4N+2 PI -elektronen heeft. Benzeen heeft 6 Pi -elektronen (4 (1) +2), die deze voorwaarde vervult.
5. Verbeterde stabiliteit: Vanwege de delocalisatie van elektronen worden de elektronen gelijkelijk gedeeld tussen alle koolstofatomen in de ring. Deze elektronen -delocalisatie stabiliseert het molecuul aanzienlijk in vergelijking met een hypothetische cyclohexatriene -structuur met geïsoleerde dubbele bindingen. Deze stabiliteit is duidelijk in de relatief lage warmtewarmte in vergelijking met cyclohexeen.
6. Aromatische eigenschappen: Benzeen vertoont eigenschappen die kenmerkend zijn voor aromatische verbindingen, zoals:
* Weerstand tegen toevoegingsreacties, die voorstander zijn van elektrofiele aromatische substitutiereacties.
* Lagere reactiviteit vergeleken met alkenen.
* Stabiliteit en een onderscheidend aroma.
Samenvattend maakt de cyclische structuur, vlakke geometrie, gedelokaliseerde PI -elektronen en de naleving van de heerschappij van Huckel benzeen een goed voorbeeld van een aromatische verbinding. De unieke elektronische structuur draagt bij aan zijn ongebruikelijke stabiliteit en karakteristiek chemisch gedrag.
 Nieuw materiaal van legering van reactorvoering biedt sterkte, weerstand
Nieuw materiaal van legering van reactorvoering biedt sterkte, weerstand Hoe u berekeningen voor microdruppels kunt uitvoeren per minuut
Hoe u berekeningen voor microdruppels kunt uitvoeren per minuut Hoe is synthesereactie en ontleding gerelateerd?
Hoe is synthesereactie en ontleding gerelateerd?  Nieuwe deuren openen:eerste synthetisch mechanisch gevoelig kaliumkanaal
Nieuwe deuren openen:eerste synthetisch mechanisch gevoelig kaliumkanaal Wat gebeurt er als kopersulfaat reageert met waterstofsulfide?
Wat gebeurt er als kopersulfaat reageert met waterstofsulfide?
 Hoe overleven reuzenpanda's?
Hoe overleven reuzenpanda's?  Wat is het bos ten zuiden van Tundra?
Wat is het bos ten zuiden van Tundra?  Bizonherintroductie in Banff - en het potentieel voor Wolf /Buffalo Showdowns
Bizonherintroductie in Banff - en het potentieel voor Wolf /Buffalo Showdowns De achteruitgang van het Caribische koraalrif begon in de jaren vijftig en zestig door lokale menselijke activiteiten
De achteruitgang van het Caribische koraalrif begon in de jaren vijftig en zestig door lokale menselijke activiteiten Bossen gaan in groeiversnelling om te herstellen van droogte
Bossen gaan in groeiversnelling om te herstellen van droogte
Hoofdlijnen
- Welk lichaamssysteem bevat het spijsverteringssysteem?
- Waar wordt messenger-RNA gehecht tijdens de eiwitconstructie?
- Wat voor soort molecuul is aanwezig in een celmembraan?
- Wat zijn de twee namen die worden gebruikt bij het identificeren van organismen?
- Hoe DNA gekoppeld aan de rol van ribosomen in een cel?
- Wat is de rol van enzymcomplex in de elektrontransportketen?
- Wat is het principe van glucose-6-fosfaatdehydrogenase?
- Wat zijn constante factoren in de wetenschap?
- Wat is frolzuur?
- Onderzoeker probeert te begrijpen hoe gonorroe resistentie tegen antibiotica ontwikkelt

- Systematische studie lost discussie over katalysatorontwerp voor uitlaatgassen van auto's op

- Modulair vloeistofsysteem ontwikkeld om radio-isotoop te leveren die wordt gebruikt bij gerichte alfatherapie
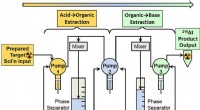
- Het op maat maken van het oppervlak van koolstof kan de sleutel zijn tot het in realtime monitoren van het bloed van de patiënt

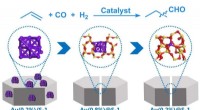
- Onderzoekers ontwikkelen nieuwe Au-katalysator voor hydroformylering
 Onderzoek in Lake Superior laat zien hoe zwavel door de oude oceanen van de aarde heeft gefietst
Onderzoek in Lake Superior laat zien hoe zwavel door de oude oceanen van de aarde heeft gefietst  Afbeelding:Bepi voor de spatie
Afbeelding:Bepi voor de spatie Een nieuwe e-nose en computervisie helpen onderzoekers de perfecte kip te koken
Een nieuwe e-nose en computervisie helpen onderzoekers de perfecte kip te koken Hoe wordt een baan gemaakt?
Hoe wordt een baan gemaakt?  Wie zijn de hoofdpersonen van October Sky?
Wie zijn de hoofdpersonen van October Sky?  SPAD VII &SPAD XIII
SPAD VII &SPAD XIII  Hoe Facebook-likes kiezers kunnen profileren voor manipulatie
Hoe Facebook-likes kiezers kunnen profileren voor manipulatie Hoe jasmonaatsignalering wordt verbeterd onder fosforarme omstandigheden in de plantenfysiologie
Hoe jasmonaatsignalering wordt verbeterd onder fosforarme omstandigheden in de plantenfysiologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

