
Wetenschap
Volgens het model van het waterstofatoom hoe wordt emissiespectrum geproduceerd?
1. energieniveaus: Het BOHR -model beschrijft het waterstofatoom als specifieke energieniveaus, aangegeven door het belangrijkste kwantumnummer (N). Het laagste energieniveau (n =1) wordt de grondtoestand genoemd, terwijl hogere niveaus (n =2, 3, 4 ...) geëxciteerde toestanden worden genoemd.
2. excitatie: Wanneer een elektron in een waterstofatoom energie absorbeert, springt het naar een hoger energieniveau. Dit kan worden veroorzaakt door verschillende middelen, zoals botsingen met andere deeltjes, absorptie van licht of elektrische ontlading.
3. Ontspanning: Het opgewonden elektron is onstabiel en zal uiteindelijk terugvallen naar een lager energieniveau. Dit proces wordt ontspanning genoemd.
4. Fotonemissie: Terwijl de elektron van een hoger energieniveau naar een lager wordt overgepacteerd, geeft het de overtollige energie af als een foton van licht. De energie van het uitgezonden foton is gelijk aan het verschil in energie tussen de twee niveaus.
5. Specifieke frequenties: Omdat de energieniveaus in het waterstofatoom worden gekwantiseerd, zijn alleen specifieke energieverschillen mogelijk. Dit resulteert in de emissie van fotonen met specifieke frequenties (en dus golflengten), die overeenkomen met de lijnen waargenomen in het waterstofemissiespectrum.
Sleutelpunten:
* Het BOHR -model voorspelt correct de waargenomen spectrale lijnen van waterstof.
* Elke lijn in het spectrum komt overeen met een specifieke elektronenovergang tussen energieniveaus.
* De meest prominente serie in het waterstofemissiespectrum zijn de Lyman Series (UV), Balmer Series (zichtbaar) en Paschen Series (IR).
Voorbeeld:
Wanneer een elektron in een waterstofatoom overgaat van het n =3 energieniveau naar het n =2 niveau, straalt het een foton van licht uit met een golflengte die overeenkomt met de rode lijn in de Balmer -serie.
Beperkingen:
Hoewel het Bohr -model met succes het waterstofemissiespectrum verklaart, heeft het beperkingen wanneer het wordt toegepast op meer complexe atomen. Het model houdt geen rekening met de fijne structuur van spectrale lijnen en breekt af voor atomen met meer dan één elektron. Moderne kwantummechanica biedt een completere beschrijving van de atomaire structuur en spectra.
 Onderzoekers ontwikkelen een betere manier om ondergrondse waterlekken op te sporen
Onderzoekers ontwikkelen een betere manier om ondergrondse waterlekken op te sporen Waarom zijn eigenschappen of wetenschappelijke kenmerken belangrijk op het gebied van wetenschap?
Waarom zijn eigenschappen of wetenschappelijke kenmerken belangrijk op het gebied van wetenschap?  Is er een boom genaamd Trash Palm?
Is er een boom genaamd Trash Palm?  Rol van plankzeeën bij het verwijderen en opslaan van koolstof en cyclische voedingsstoffen onthuld
Rol van plankzeeën bij het verwijderen en opslaan van koolstof en cyclische voedingsstoffen onthuld Nieuwe wereldwijde database zal wetenschappers helpen de rol van meren in de ecologie van de aarde te volgen
Nieuwe wereldwijde database zal wetenschappers helpen de rol van meren in de ecologie van de aarde te volgen
Hoofdlijnen
- Wat is Agrobacterium gemedieerde genoverdracht?
- Waarom worden groene algen geclassificeerd als planten en geen protist?
- Hoe bacteriën zwemmen:onderzoekers ontdekken nieuwe mechanismen
- Sociale wespen laten zien hoe grotere hersenen voor complexe cognitie zorgen
- Wat zijn de twee belangrijkste functies van lipiden bij mensen?
- Verschillen tussen lichaamscellen en neuronen
- Twee fasen van fotosynthese
- Wat is het tegenovergestelde van homozygote dominant?
- Wat moet een cel van eukaryote DNA vasthouden die prokaryote niet heeft?
- Het wijzigen van de genen van zijderupsen om de toevoeging van nuttige eiwitten aan de zijdeproductie te veroorzaken

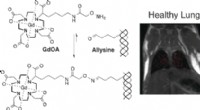
- Niet-invasieve magnetische resonantiebeeldvorming van longfibrogenese met een op aminozuren gerichte sonde
- Interactieve kwantumchemie in virtual reality

- Wetenschappers voorspellen nieuwe superharde materialen

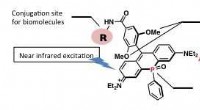
- Een nabij-infrarood fluorescerende kleurstof voor bio-imaging op lange termijn
 Wiskunde Projecten voor hoogbegaafde & getalenteerde kinderen van de vijfde klas
Wiskunde Projecten voor hoogbegaafde & getalenteerde kinderen van de vijfde klas  Welke functie is geen gevolg van het uitharden van stenen van gletsjers terwijl het beweegt?
Welke functie is geen gevolg van het uitharden van stenen van gletsjers terwijl het beweegt?  Cycloontol bereikt 95 terwijl Bangladesh en India beginnen op te dweilen
Cycloontol bereikt 95 terwijl Bangladesh en India beginnen op te dweilen Wat is de omvang van vector 15 ft s down?
Wat is de omvang van vector 15 ft s down?  Internationaal team van natuurkundigen blijft zoeken naar nieuwe natuurkunde
Internationaal team van natuurkundigen blijft zoeken naar nieuwe natuurkunde Wat is de oorzaak van het bestaan van zwaartekracht in het heelal?
Wat is de oorzaak van het bestaan van zwaartekracht in het heelal?  How does plate tectonics affect surface?
How does plate tectonics affect surface?  Internationaal onderzoeksproject onderzoekt lichtgevoelige koolstofnanodeeltjes
Internationaal onderzoeksproject onderzoekt lichtgevoelige koolstofnanodeeltjes
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

