
Wetenschap
Waarom is het smeltpunt van magnesiumoxide veel hoger dan natriumchloride?
1. Ionische bindingssterkte:
* mgo: Magnesium en zuurstof hebben een groot verschil in elektronegativiteit, wat leidt tot een zeer sterke ionische binding. De kleine ionische stralen van mg²⁺ en o²⁻ verbeteren verder de elektrostatische aantrekkingskracht daartussen.
* NaCl: Natrium en chloor hebben een kleiner elektronegativiteitsverschil, wat resulteert in een zwakkere ionische binding. Natrium- en chloride -ionen zijn ook groter, wat de elektrostatische aantrekkingskracht daartussen verder vermindert.
2. Roosterstructuur:
* mgo: MGO neemt de rotszoutstructuur aan, een zeer symmetrische en stabiele roosterstructuur. Het naderen van ionen in deze structuur draagt bij aan het hoge smeltpunt.
* NaCl: NaCl neemt ook de structuur van de rotszout aan, maar de zwakkere ionische bindingen resulteren in een minder stabiel rooster in vergelijking met MGO.
3. Covalent karakter:
* mgo: Ondanks het feit dat het voornamelijk ionisch is, vertoont MGO een zekere mate van covalent karakter vanwege de kleine omvang en hoge ladingsdichtheid van de ionen. Dit covalente karakter versterkt de binding verder.
* NaCl: NaCl heeft een veel lagere mate van covalent karakter, wat bijdraagt aan zijn zwakkere binding.
4. Polariseerbaarheid:
* mgo: Magnesium- en zuurstofionen zijn minder polariseerbaar dan natrium- en chloride -ionen. Dit betekent dat ze minder geneigd zijn hun elektronenwolken te vervormen onder invloed van naburige ionen, wat leidt tot een stabieler rooster.
5. Van der Waals Forces:
* mgo: De zwakke Van der Waals -krachten tussen MGO -moleculen zijn te verwaarlozen in vergelijking met de sterke ionische binding.
* NaCl: Hoewel de ionische binding in NaCl zwakker is dan in MGO, speelt het nog steeds een belangrijke rol bij het bij elkaar houden van het rooster. Van der Waals -krachten tussen NaCl -moleculen zijn echter sterker vanwege hun grotere omvang en grotere polariseerbaarheid.
Samenvattend draagt de aanzienlijk sterkere ionische binding, stabielere roosterstructuur en lagere polariseerbaarheid van MGO bij aan het veel hogere smeltpunt in vergelijking met natriumchloride.
 Wat zijn de 3 eigenschappen van subatomaire deeltjes?
Wat zijn de 3 eigenschappen van subatomaire deeltjes?  Goud wordt toegevoegd aan een oplossing van calciumchloride?
Goud wordt toegevoegd aan een oplossing van calciumchloride?  Nieuwe manier van testen op cocaïne ontdekt
Nieuwe manier van testen op cocaïne ontdekt Welke van de volgende wijzigingen geeft toestand vrij van thermische energie A. smelten C. condensatie B. Sublimatie D. evaportion?
Welke van de volgende wijzigingen geeft toestand vrij van thermische energie A. smelten C. condensatie B. Sublimatie D. evaportion?  Wat zijn niet -metalen objecten?
Wat zijn niet -metalen objecten?
 Lijst met dingen die schelpen hebben
Lijst met dingen die schelpen hebben  Is de Maya-beschaving geëindigd vanwege de klimaatverandering?
Is de Maya-beschaving geëindigd vanwege de klimaatverandering?  Extreem weer in Europa gekoppeld aan minder zee-ijs en opwarming in de Barentszzee
Extreem weer in Europa gekoppeld aan minder zee-ijs en opwarming in de Barentszzee Zuurstof had al 3,5 miljard jaar geleden beschikbaar kunnen zijn voor leven
Zuurstof had al 3,5 miljard jaar geleden beschikbaar kunnen zijn voor leven Dorstig in het paradijs:Watercrises zijn een groeiend probleem op de Caribische eilanden
Dorstig in het paradijs:Watercrises zijn een groeiend probleem op de Caribische eilanden
Hoofdlijnen
- Wat identificeert een X- en Y -chromosoom?
- Structuur die elk chromosoom op zijn exacte kopie houdt?
- Wat is de laatste gemeenschappelijke voorouder?
- Wat is het verschil tussen een mens en een fruitvlieg?
- Nieuw ontdekt proces van seksuele voortplanting bevordert het begrip van de evolutie van planten en algen
- Wat is een Hullocigen?
- Welke groenten hebben calcium?
- Genetisch gemodificeerd voedsel, wie moet het vertellen?
- Welk dier zou het meest worden getroffen als veel bomen aan ziekten stierven?
- Onderzoekers ontwikkelen celzuigtechnologie
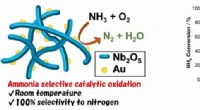
- Doorbraak in luchtzuivering met een katalysator die werkt bij kamertemperatuur
- Onderzoekers testen Lamborghini's koolstofvezelmaterialen in de ruimte

- Nieuw inzicht brengt duurzame waterstof een stap dichterbij

- Microscopietechniek onthult details op nanoschaal van coatings terwijl ze drogen

 Zilveren voering:zilver toevoegen aan nanoclusters kan wonderen doen voor hun luminescentie
Zilveren voering:zilver toevoegen aan nanoclusters kan wonderen doen voor hun luminescentie Caitlyn Jenners invloed op transgender politieke attitudes gemeten in nieuwe studie
Caitlyn Jenners invloed op transgender politieke attitudes gemeten in nieuwe studie Wat is endocytose en hoe ze werken?
Wat is endocytose en hoe ze werken?  CuPID CubeSat krijgt een nieuw perspectief op de grens tussen zon en aarde
CuPID CubeSat krijgt een nieuw perspectief op de grens tussen zon en aarde Verschil tussen een zilveren en een grijze gestreepte kat Cat
Verschil tussen een zilveren en een grijze gestreepte kat Cat De betekenis van Penta E
De betekenis van Penta E  Kolenverwijderingsverdrag dringend nodig
Kolenverwijderingsverdrag dringend nodig Wat gebeurt er wanneer gebalanceerde krachten worden toegepast op een niet -bewegend object?
Wat gebeurt er wanneer gebalanceerde krachten worden toegepast op een niet -bewegend object?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

