
Wetenschap
Hoeveel milliliter water is nodig om een oplossing van 0,171 M te maken die 1,00 g NaCl bevat?
1. Bereken de mol NaCl:
* Molaire massa NaCl: 58.44 g/mol
* mol NaCl: (1,00 g NaCl) / (58,44 g / mol) =0,0171 mol NaCl
2. Bereken het volume van oplossing:
* molariteit (m): 0,171 mol/l
* volume (l): (0,0171 mol NaCl) / (0,171 mol / l) =0,1 l
* volume (ml): 0,1 L * 1000 ml/L =100 ml
Daarom zou u 100 ml water nodig hebben om een oplossing van 0,171 m te maken die 1,00 g NaCl bevat.
Belangrijke opmerking: Deze berekening veronderstelt dat het volume van de NaCl te verwaarlozen is in vergelijking met het volume water. In werkelijkheid zal het toevoegen van de NaCl het totale volume van de oplossing enigszins vergroten. Voor zeer geconcentreerde oplossingen kan dit verschil aanzienlijk zijn, maar voor dit specifieke geval is de veronderstelling redelijk.
 Wat is de PH en geleidbaarheid in DM-water?
Wat is de PH en geleidbaarheid in DM-water?  Welke opening wordt genoemd waarin de chemische stof vrijkomt?
Welke opening wordt genoemd waarin de chemische stof vrijkomt?  Welke van deze faseveranderingen houdt NIET in dat een vloeistof in een gas verandert?
Welke van deze faseveranderingen houdt NIET in dat een vloeistof in een gas verandert?  Wetenschappers onderzoeken racemasen en stellen strategieën voor om medicijnen te vinden die zich richten op deze belangrijke enzymen
Wetenschappers onderzoeken racemasen en stellen strategieën voor om medicijnen te vinden die zich richten op deze belangrijke enzymen Welk proces gebruikt enzymen om grote moleculen kleinere absorbeerbare moleculen af te breken?
Welk proces gebruikt enzymen om grote moleculen kleinere absorbeerbare moleculen af te breken?
Hoofdlijnen
- Wat beschrijft het beste chromosomale verwijdering?
- Planten kunnen zichzelf verdedigen door rupsen kannibaal te maken
- Wel of niet steken? Hoe bijen verdedigingsgedrag organiseren
- Onder het zee-ijs, aanschouw de oude Arctische kwallen
- Wat zijn twee manieren waarop organismen verbonden zijn met de niet -levende omgeving?
- Wat voor soort bacteriën is in antibiotica coccus bacillus of spirillum?
- Wat zijn gebruik van microscoop?
- Wat is een radicale biologie?
- Hoe maken cellen orgaansystemen?
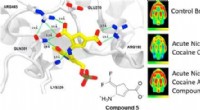
- Een verbeterd medicijn tegen verslaving
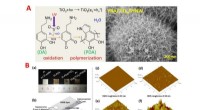
- Nieuwe zelf-assemblerende eiwithydrogels kunnen vele toepassingen voor biogeneeskunde bevatten

- Orde brengen in chaotische bubbels kan mijnbouw duurzamer maken

- Wetenschappers ontdekken natuurlijke plantaardige conserveermiddelen

- Nieuw voorgestelde strategie biedt slimme flexibele neurale elektrode met hoge efficiëntie
 Vijfentwintig kilo is hoeveel pond?
Vijfentwintig kilo is hoeveel pond?  De ultraviolette achtergrond van het universum kan aanwijzingen geven over ontbrekende sterrenstelsels
De ultraviolette achtergrond van het universum kan aanwijzingen geven over ontbrekende sterrenstelsels Hoe bladsnijdermieren een schimmeltuin cultiveren om planten af te breken, zou inzicht kunnen geven in toekomstige biobrandstoffen
Hoe bladsnijdermieren een schimmeltuin cultiveren om planten af te breken, zou inzicht kunnen geven in toekomstige biobrandstoffen  Wanneer een metaalcarbonaat wordt verwarmd, ontleedt zich in oxide en een?
Wanneer een metaalcarbonaat wordt verwarmd, ontleedt zich in oxide en een?  Hoeveel neutronen zitten er in koolstof-12?
Hoeveel neutronen zitten er in koolstof-12?  Welk type elektromagnetische golven worden uit de zon uitgestoten?
Welk type elektromagnetische golven worden uit de zon uitgestoten?  Een auto en een vrachtwagen hebben botsing, heeft een massa 8 keer de van of beweegt op 60 kmhr stationair Hoe snel bewegen twee na hun niet -elastische botsing?
Een auto en een vrachtwagen hebben botsing, heeft een massa 8 keer de van of beweegt op 60 kmhr stationair Hoe snel bewegen twee na hun niet -elastische botsing?  Russisch ruimtewapen:antisatellietsystemen zijn willekeurig en vormen een risico voor ieders ruimtevaartuig
Russisch ruimtewapen:antisatellietsystemen zijn willekeurig en vormen een risico voor ieders ruimtevaartuig
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

