
Wetenschap
Hoe verschilt aluminium en natrium van elkaar?
1. Atomische structuur en eigenschappen:
* aluminium (AL): Heeft 13 protonen, 13 elektronen en 14 neutronen (in zijn meest voorkomende isotoop). Het is een post-transitie metaal Gelegen in groep 13 van het periodiek systeem. Aluminium is relatief licht , Strong , en resistent tegen corrosie Vanwege een beschermende oxidelaag die zich op het oppervlak vormt.
* natrium (NA): Heeft 11 protonen, 11 elektronen en 12 neutronen (in zijn meest voorkomende isotoop). Het is een alkali metal Gelegen in groep 1 van het periodiek systeem. Natrium is zacht, zilverachtig wit , en zeer reactief met water en lucht.
2. Reactiviteit:
* aluminium: Hoewel reactief, maakt de oxidelaag van aluminium het relatief niet -reactief Bij kamertemperatuur. Het reageert met zuren, maar niet met basen.
* natrium: Extreem reactief, zelfs met lucht en water. Het reageert heftig met water en laat waterstofgas en warmte vrij. Het reageert met zuren en basen.
3. Gebruik:
* aluminium: Op grote schaal gebruikt in constructie, transport, verpakking en consumentengoederen vanwege zijn lichtheid, sterkte en weerstand tegen corrosie.
* natrium: Gebruikt in verschillende industriële processen zoals productie van natriumhydroxide, natriumchloride (tafelzout) en natriumlampen. Het wordt ook gebruikt in batterijen en als warmteoverdrachtsmedium.
4. Uiterlijk:
* aluminium: Zilvergrijze kleur, meestal saai vanwege de oxidelaag.
* natrium: Zilverachtig wit, zeer reactief metaal dat snel in de lucht aftast.
5. Fysieke eigenschappen:
* aluminium: Smeltpunt:660.32 ° C (1220,58 ° F), kookpunt:2519 ° C (4566 ° F), dichtheid:2,70 g/cm3
* natrium: Smeltpunt:97,72 ° C (207,90 ° F), kookpunt:883 ° C (1621 ° F), dichtheid:0,97 g/cm3
Samenvattend: Aluminium is een sterk, duurzaam metaal met een beschermende oxidelaag, terwijl natrium een zacht, zeer reactief metaal is. Hun verschillen in reactiviteit, toepassingen en fysische eigenschappen zijn te wijten aan hun verschillende atoomstructuren en posities op het periodieke tabel.
 Waarom is een ring gemaakt van platina -dichter dan van dezelfde grootte zilver?
Waarom is een ring gemaakt van platina -dichter dan van dezelfde grootte zilver?  Geavanceerde nucleaire magnetische resonantietechniek onthult precieze structurele, dynamische details in zeolieten
Geavanceerde nucleaire magnetische resonantietechniek onthult precieze structurele, dynamische details in zeolieten  Kies de wet die bij deze definitie past. Als de temperatuur van een gas toeneemt, moet het volume ook toenemen om een constante druk te behouden?
Kies de wet die bij deze definitie past. Als de temperatuur van een gas toeneemt, moet het volume ook toenemen om een constante druk te behouden?  Massa van één molecuul waterstof?
Massa van één molecuul waterstof?  Welke dingen gemaakt door thermohardende kunststoffen?
Welke dingen gemaakt door thermohardende kunststoffen?
 Ons fysieke begrip van klimaatprocessen verbeteren met behulp van verbeterde klimaatmodellen
Ons fysieke begrip van klimaatprocessen verbeteren met behulp van verbeterde klimaatmodellen Onderzoeker voorspelt toekomst waarin mensen leven van insecten
Onderzoeker voorspelt toekomst waarin mensen leven van insecten Bergen aan gegevens:een ongekend klimaatobservatorium om de toekomst van water te begrijpen
Bergen aan gegevens:een ongekend klimaatobservatorium om de toekomst van water te begrijpen Speciale uitgave om klimaatwetenschap voor servicepartnerschap tussen China en het VK onder de aandacht te brengen
Speciale uitgave om klimaatwetenschap voor servicepartnerschap tussen China en het VK onder de aandacht te brengen Welk diertype is een inktvis?
Welk diertype is een inktvis?
Hoofdlijnen
- Waarom worden experimenten waarbij transplanterende soorten worden uitgevoerd die vandaag zelden worden uitgevoerd?
- Wat is xeotherm?
- Hoeveel verschillende Kindoms van organismen zijn er?
- Het visfeest is in wezen een benzinestation en trekt zeeleeuwen naar Pier 39 in aantallen die in 15 jaar niet meer zijn gezien
- Wat zijn cellen en andere niet -opgeloste deeltjes in bloed geroepen?
- Grootste genetische studie van muggen onthult verspreiding van resistentie tegen insecticiden in Afrika
- Waarom vissen praten:communicatie met anemoonvissen vestigt status in sociale groepen (met video)
- Vijf stappen om Agar te bereiden Slants
- Wat is de wetenschappelijke naam voor Phylum Protozoa?
- Nieuwe verwerkingstechniek kan aardappelen gezonder maken
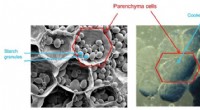
- Studie doet twijfel rijzen over de nauwkeurigheid van mobiele apparaten voor het testen van medicijnen

- Vloeistoffen filteren met vloeistoffen bespaart elektriciteit

- Macromoleculaire orde in plastic koninkrijk

- Met behulp van licht, rode bloedcellen en een honingbijpeptide om therapeutische eiwitten te leveren
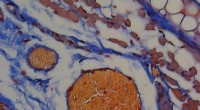
 Californië haast zich om olieramp in te dammen als dieren in het wild, stranden hit
Californië haast zich om olieramp in te dammen als dieren in het wild, stranden hit Waarom leidt de verwijdering van planten en bomen tot milieuwetenschap van bodemerosie?
Waarom leidt de verwijdering van planten en bomen tot milieuwetenschap van bodemerosie?  Welke formule gebruikt u om de bewegingssnelheid te verkalken?
Welke formule gebruikt u om de bewegingssnelheid te verkalken?  Team ontwikkelt methode om ongrijpbare elektronen te vangen
Team ontwikkelt methode om ongrijpbare elektronen te vangen Drijvende robots laten zien hoeveel stof in de lucht de Zuidelijke Oceaan bevrucht – een belangrijke klimaatschokdemper
Drijvende robots laten zien hoeveel stof in de lucht de Zuidelijke Oceaan bevrucht – een belangrijke klimaatschokdemper  Waarom wordt aardwarmte niet overal gebruikt?
Waarom wordt aardwarmte niet overal gebruikt?  Tol tyfoon Phanfone op Filipijnen stijgt naar 28
Tol tyfoon Phanfone op Filipijnen stijgt naar 28 Wie heeft moleculen ontdekt?
Wie heeft moleculen ontdekt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

