
Wetenschap
Heeft zuurstof meer elektronenaffiniteit dan zwavel?
Dit is waarom:
* Elektronenaffiniteit is de verandering in energie wanneer een elektron wordt toegevoegd aan een neutraal atoom om een negatief ion te vormen. Een hogere elektronenaffiniteit betekent dat het atoom een grotere neiging heeft om een elektron te krijgen.
* zuurstof heeft een kleinere atoomradius dan zwavel. Dit betekent dat het toegevoegde elektron in zuurstof dichter bij de kern ligt en een sterkere aantrekkingskracht ervaart. Zuurstof heeft echter al een relatief hoge elektronegativiteit, waardoor het moeilijker is om een ander elektron toe te voegen vanwege de afstoting van elektronen-elektronen.
* zwavel Heeft een grotere atoomradius en plaatst het toegevoegde elektron verder van de kern. Deze zwakkere aantrekkingskracht wordt gecompenseerd door het feit dat zwavel minder elektronen heeft dan zuurstof, wat leidt tot minder elektron-elektronenafstoting en een grotere algemene aantrekkingskracht voor het toegevoegde elektron.
Daarom heeft zwavel, ondanks de kleinere zuurstof, een hogere elektronenaffiniteit.
 Welke kracht trekt alle materie aan?
Welke kracht trekt alle materie aan?  Natuurlijke materialen gebruikt voor waterfiltratie
Natuurlijke materialen gebruikt voor waterfiltratie bosbranden, houtkap beïnvloedt schimmels waarvan dennenbossen afhankelijk zijn om te overleven, onderzoeken tonen aan
bosbranden, houtkap beïnvloedt schimmels waarvan dennenbossen afhankelijk zijn om te overleven, onderzoeken tonen aan NASA's GPM analyseerde regenval in ex-tropische cycloon 11S
NASA's GPM analyseerde regenval in ex-tropische cycloon 11S Regenwater besparen voor huishoudelijk gebruik
Regenwater besparen voor huishoudelijk gebruik
Hoofdlijnen
- De geografische isolatie van twee populaties Een soort heeft de neiging om de verschillen tussen hun genenpools te vergroten omdat het?
- Stijging van het aantal zee-egels en de daarmee samenhangende schade aan kelpbossen heeft gevolgen voor de grijze walvissen in Oregon en hun voedsel, zo blijkt uit onderzoek
- Hoe noem je een woord van 3 letters op mRNA -molecuul?
- Welke Arer Carnivor?
- Wat is de vorm van mRNA?
- Is Neutrofil een prokaryote of eukaryote?
- Levende cellen komen alleen van bestaande wordt genoemd?
- Evolutiebiologen laten zien dat de kleurvarianten van vrouwelijke koekoeken gebaseerd zijn op oude mutaties
- Hoe verschillen twee dochtercellen?
- Chemische verbinding produceert gunstige ontstekingen, remyelinisatie die kan helpen bij de behandeling van MS
- Vijf rare en prachtige manieren waarop de natuur wordt aangewend om een duurzame mode-industrie op te bouwen

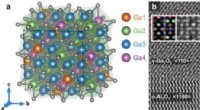
- Galliumoxidekristalcomplexiteit getemd door machine learning
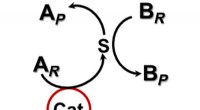
- Chemische reacties versnellen zonder direct contact met een katalysator
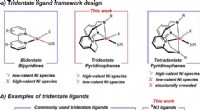
- Nieuw molecuul zet de toon voor nikkel als groenere fotokatalysator, onthult belangrijke stappen in reactieproces
 Moord neemt wereldwijd af, maar waarom?
Moord neemt wereldwijd af, maar waarom? Nep Apple-producten:hier leest u hoe u kunt voorkomen dat u voor de gek gehouden wordt - en in gevaar wordt gebracht - door vervalsingen
Nep Apple-producten:hier leest u hoe u kunt voorkomen dat u voor de gek gehouden wordt - en in gevaar wordt gebracht - door vervalsingen Fossiele brandstofbedrijven krijgen $ 62 miljard per jaar aan impliciete subsidies, econoom rapporten
Fossiele brandstofbedrijven krijgen $ 62 miljard per jaar aan impliciete subsidies, econoom rapporten Heldere rode laag zonoppervlak dat waterstofgas bevat?
Heldere rode laag zonoppervlak dat waterstofgas bevat?  Verschil tussen windenergie en energie?
Verschil tussen windenergie en energie?  Waar gebruik je de telescoop in Club Penguin?
Waar gebruik je de telescoop in Club Penguin?  Is paardenkracht een niet -hernieuwbare bron?
Is paardenkracht een niet -hernieuwbare bron?  Bestaat pyriet uit calciumcarbonaat?
Bestaat pyriet uit calciumcarbonaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

