
Wetenschap
Waarom ontstaat zuurstof bij anode in elektrolyse van water?
Inzicht in de basis
* elektrolyse: Het proces van het gebruik van elektriciteit om een verbinding in zijn elementen af te breken.
* anode: De positieve elektrode in een elektrolytische cel.
* kathode: De negatieve elektrode in een elektrolytische cel.
de chemie
1. De chemische structuur van het water: Water (H₂o) is een polair molecuul met een enigszins positieve lading op de waterstofatomen en een enigszins negatieve lading op het zuurstofatoom.
2. Elektrode -aantrekkingskracht:
* anode (positief): Trekt negatief geladen ionen (anionen) aan zoals hydroxide -ionen (OH⁻).
* kathode (negatief): Trekt positief geladen ionen (kationen) zoals waterstofionen (H⁺) aan.
3. reacties bij de anode:
* oxidatie: Het proces van het verliezen van elektronen. Bij de anode verliezen hydroxide -ionen (OH⁻) elektronen om zuurstofgas te vormen (O₂):
4OH⁻ → 2h₂o + o₂ + 4e⁻
Waarom zuurstof ontstaat bij de anode:
* oxidatie: De positieve lading van de anode bevordert het verlies van elektronen (oxidatie). Zuurstof, meer elektronegatief dan waterstof, accepteert gemakkelijk elektronen om zuurstofgas te vormen.
* Vorming van waterstofionen: De vorming van zuurstofgas genereert ook waterstofionen (H⁺) die migreren naar de kathode.
Samenvattend
De positieve lading van de anode en de neiging van hydroxide -ionen om elektronen bij deze elektrode te verliezen, leiden tot de vorming van zuurstofgas tijdens de elektrolyse van water.
 Gemeenschap neemt met tegenzin afscheid van 600 jaar oude boom
Gemeenschap neemt met tegenzin afscheid van 600 jaar oude boom Waar komen de fysieke eigenschappen die we overerven vandaan?
Waar komen de fysieke eigenschappen die we overerven vandaan?  De ineenstorting van het klimaat verhoogt in feite de economische waarde van de poolzeeën - pas op voor de zakelijke opportunisten
De ineenstorting van het klimaat verhoogt in feite de economische waarde van de poolzeeën - pas op voor de zakelijke opportunisten Onderzoekers vinden ongebruikelijk fenomeen in wolken dat bliksemflits veroorzaakt
Onderzoekers vinden ongebruikelijk fenomeen in wolken dat bliksemflits veroorzaakt Afgesneden van de wereld, een Indiaas eiland blijft een mysterie
Afgesneden van de wereld, een Indiaas eiland blijft een mysterie
Hoofdlijnen
- Waarom zijn bacteriën belangrijk voor de stikstofcyclus?
- Waarom cellen schakelen van aerobe naar anaërobe tijdens een race?
- Biologen leren hoe planten hun groeihormoon auxine synthetiseren
- Hebben garnalen een zenuwstelsel?
- Hoe is ATP -synthase betrokken bij het maken van energie van de cel?
- Wat zou de complementaire DNA zijn voor sequentie CTTAGGCTTACCA?
- Eigenschap die de kans op een soort verbetert om te overleven?
- Waarom worden picogenen zo genoemd?
- Gebruik je echt maar 10 procent van je hersenen?
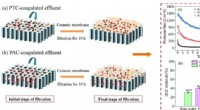
- Polytitaniumchloride pre-coagulatie voor vervuilingscontrole van keramisch membraan
- Doe zoals de Romeinen:beton in elektriciteitscentrales wordt met de tijd sterker

- Doorbraak in het begrijpen van enzymen die antibiotica maken voor resistente ziekteverwekkers

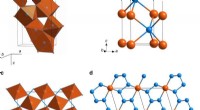
- Wetenschappers creëren op een eenvoudige manier onmogelijke materialen
- Technologie op laboratoriumschaal recyclet afvalwater tot waterstof voor gebruik bij de productie van brandstof

 Een nieuw ontwikkelingskader zou robots in staat kunnen stellen om autonoom hyperparameters te optimaliseren
Een nieuw ontwikkelingskader zou robots in staat kunnen stellen om autonoom hyperparameters te optimaliseren Wat is het verschil tussen covalente en ionenbindingen?
Wat is het verschil tussen covalente en ionenbindingen?  Wat zijn middelenmaterialen die u thuis of werk gebruikt?
Wat zijn middelenmaterialen die u thuis of werk gebruikt?  Materiaaltheorie combineert kracht, stijfheid en taaiheid van composieten in één ontwerpkaart
Materiaaltheorie combineert kracht, stijfheid en taaiheid van composieten in één ontwerpkaart Een dans van twee:het afstemmen van interacties tussen afgelegen vloeistoffen van excitonen
Een dans van twee:het afstemmen van interacties tussen afgelegen vloeistoffen van excitonen Wetenschappers bereiken hoog vermogen met nieuwe kleinere laser
Wetenschappers bereiken hoog vermogen met nieuwe kleinere laser Is papier een isolator of geleider?
Is papier een isolator of geleider?  Wat is UNIFOM -snelheid?
Wat is UNIFOM -snelheid?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

