
Wetenschap
Hoe vormen anion van stikstofvormen?
* Hoge elektronegativiteit: Stikstof is zeer elektronegatief, wat betekent dat het elektronen sterk aantrekt. Dit maakt het moeilijk voor stikstof om elektronen te winnen en negatief geladen te worden.
* Kleine atoommaat: Stikstof heeft een kleine atoomradius. Wanneer het elektronen wint, worden de toegevoegde elektronen dicht bij de kern gehouden en ervaren ze een sterke elektrostatische afstoting. Dit maakt het energetisch ongunstig voor stikstof om eenvoudige anionen te vormen.
In plaats van eenvoudige anionen te vormen, vormt stikstof meestal:
* Covalente bindingen: Stikstof deelt gemakkelijk elektronen met andere atomen en vormen covalente bindingen. Dit is hoe het moleculen vormt zoals ammoniak (NH3) en stikstofgas (N2).
* nitriden: In sommige gevallen kan stikstof reageren met zeer elektropositieve metalen om nitriden te vormen. Nitriden zijn verbindingen waar stikstof een formele negatieve lading heeft, maar het is geen eenvoudig anion zoals Cl- of O2-. Deze verbindingen zijn meestal ionisch van aard.
Voorbeeld: In lithiumnitride (LI3N) heeft het stikstofatoom een formele lading van -3, maar het is geen vrij zwevend anion. Het stikstofatoom is gebonden aan drie lithiumatomen en vormt een stabiele ionische verbinding.
Samenvattend: De hoge elektronegativiteit en kleine omvang van stikstof maken het moeilijk om eenvoudige anionen te vormen. In plaats daarvan vormt het meestal covalente bindingen of nitriden, waarbij het elektronen deelt of ionische bindingen vormt met zeer elektropositieve metalen.
 Zoutzuur plus natriumhydroxide is gelijk aan?
Zoutzuur plus natriumhydroxide is gelijk aan?  Is de snelheid van diffusie -inkt in water en honing hetzelfde.
Is de snelheid van diffusie -inkt in water en honing hetzelfde.  Wat is het verschil tussen fysische en chemische verweringsverandering?
Wat is het verschil tussen fysische en chemische verweringsverandering?  Welke atomen zullen, wanneer ze aan waterstof gebonden zijn, bindingen vormen?
Welke atomen zullen, wanneer ze aan waterstof gebonden zijn, bindingen vormen?  Hoe is een neerslagbewijs voor chemische reactie?
Hoe is een neerslagbewijs voor chemische reactie?
 Wereldwijde CO2-uitstoot daalt met 4-7% in 2020, maar zal het uitmaken?
Wereldwijde CO2-uitstoot daalt met 4-7% in 2020, maar zal het uitmaken? Voordelen en nadelen van biologische controle
Voordelen en nadelen van biologische controle  Ontbossing Braziliaanse Amazone bereikt record in april
Ontbossing Braziliaanse Amazone bereikt record in april Wat is de betekenis van regenwoud van Judith Wright?
Wat is de betekenis van regenwoud van Judith Wright?  Waarom is het een goed idee om experimentele proefpersonen te bestuderen over hun natuurlijke omgeving?
Waarom is het een goed idee om experimentele proefpersonen te bestuderen over hun natuurlijke omgeving?
Hoofdlijnen
- Hoe maak je van kelp-aquacultuur een betere koolstofput
- Waarom slimme groei spelers in het systeem frustreert:studie
- Onderzoekscontrole:is het waar dat slechts de helft van je vrienden je echt leuk vindt?
- Indringende vraag:Wat is zaadbankieren?
- Biologie 10e klas Guide of Chapter Life Processes?
- De meeste hondensnoepjes overschrijden de aanbevolen dagelijkse hoeveelheid energie
- Ondanks de wet stijgt het aantal doden door loodvergiftiging in New Hampshire
- Baseparen in menselijke haploïde cel?
- Wat zijn de factoren die de groei en deling van cellen regelen?
- Met vloeistof doordrenkt glad oppervlak presteert beter dan superhydrofoob oppervlak wat betreft langdurige corrosiebestendigheid

- Het meest nauwkeurige beeld van Zika tot nu toe creëert potentieel voor therapieën
- Bayer verliest opnieuw beroep tegen Roundup-vonnis over kanker

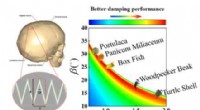
- De relatie tussen delicate hechtdraadstructuur en dempende prestaties van biomaterialen
- Gegevenssnelheden in de cloud gaan omhoog met behulp van mini-lasermagneten
 Californië verlaagt kortingen op elektrische auto's laat luxe modellen vallen
Californië verlaagt kortingen op elektrische auto's laat luxe modellen vallen Wetenschappers proberen oude slachtmethoden na te bootsen en leren hoe Neanderthalers vogels aten
Wetenschappers proberen oude slachtmethoden na te bootsen en leren hoe Neanderthalers vogels aten  Vraagzijde versus vraagzijde economie
Vraagzijde versus vraagzijde economie Voorschoolse leraren hebben een betere opleiding in de wetenschap nodig
Voorschoolse leraren hebben een betere opleiding in de wetenschap nodig Wat zijn de platen van Haïti en Chili die botsen?
Wat zijn de platen van Haïti en Chili die botsen?  Gigameters converteren naar meters
Gigameters converteren naar meters  Nadat atomen en moleculen van gassen worden verwarmd, gaan ze weg van de hitte. Wat neemt hun plaats aan?
Nadat atomen en moleculen van gassen worden verwarmd, gaan ze weg van de hitte. Wat neemt hun plaats aan?  Hoeveel energie is er nodig om 100 liter water in 1 minuut met 23 graden te verwarmen?
Hoeveel energie is er nodig om 100 liter water in 1 minuut met 23 graden te verwarmen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

