
Wetenschap
Vorm van broommonofluoride gebogen of lineair?
Dit is waarom:
* elektronegativiteit: Fluor is veel elektronegatiefer dan broom. Dit betekent dat de bindingselektronen sterker worden getrokken naar het fluoratoom.
* eenzame paren: Bromine heeft 7 valentie -elektronen en vormt een enkele binding met fluor. Hierdoor blijft 3 eenzame paren op het broomatoom. Deze enige paren bevinden zich in hetzelfde vlak als de BR-F-binding, wat een gemeenschappelijke opstelling is voor halogenen.
* vSEPR -theorie: Volgens de VSEPR-theorie regelen de elektronenparen (binding en niet-binden) zichzelf om afstoting te minimaliseren. In het geval van BRF is de meest stabiele opstelling lineair, waarbij de enige paren zo ver mogelijk uit elkaar staan van elkaar en de BR-F-binding.
Daarom is de vorm van broommonofluoride lineair.
Hoofdlijnen
- Wat is de juiste volgorde voor de volgorde van de meiose?
- Welke rol speelt een kikker in het ecosysteem?
- Uit onderzoek blijkt dat plastic vezels de groei van mosselen met meer dan een derde belemmeren. Dit is waarom dit zorgwekkend is
- Zijn protozoa een soort eencellige organismen?
- Waarom kiezen oesters ervoor om te leven waar ze gegeten kunnen worden?
- Hoe je de aantallen zwerfkatten terugdringt op een manier die voor iedereen beter werkt
- mRNA: definitie, functie en structuur
- Wat is het proces waarmee grote moleculen de cel achterlaten in blaasjes die Golgi -lichamen ontsnappen?
- Wat is de stabilisatie van een enzym?
- Het beoordelen van de risico's van vetwerende chemicaliën in voedselverpakkingen vereist nieuwe methoden, studies

- Hoe maken we waterstof uit steenkool, en is het echt een schone brandstof?
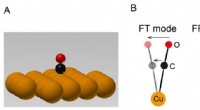
- Opheldering van trillingsenergie van een enkel molecuul in een extern krachtveld
- Methode voor het volgen van reacties tussen lucht en op koolstof gebaseerde verbindingen vastgesteld

- Onderzoekers ontwikkelen een nieuw raman-spectroscopieplatform om IDP's in verdunde oplossing te karakteriseren

 Welk woord kenmerkt het beste de onderste mantel?
Welk woord kenmerkt het beste de onderste mantel?  Is een plant en boom hetzelfde?
Is een plant en boom hetzelfde?  Werkconnectiviteit verbetert de veerkracht in Amerikaanse steden, studie vondsten
Werkconnectiviteit verbetert de veerkracht in Amerikaanse steden, studie vondsten Hoe de genoomdiversiteit van belangrijke gewassen hun evolutie vertelt
Hoe de genoomdiversiteit van belangrijke gewassen hun evolutie vertelt  Nieuw boek onthult in hoeverre vrouwen ondergewaardeerd zijn in wereldwijde waardeketens
Nieuw boek onthult in hoeverre vrouwen ondergewaardeerd zijn in wereldwijde waardeketens Wat is de versnelling van een kg -object -zwaartekracht, trekt er naar beneden, maar luchtweerstand duwt omhoog met N?
Wat is de versnelling van een kg -object -zwaartekracht, trekt er naar beneden, maar luchtweerstand duwt omhoog met N?  Obama:onze 22e grootste president?
Obama:onze 22e grootste president?  Een elektriciteitscentrale verbrandt kolen en genereert gemiddeld 610,0 MW elektrisch terwijl 963,80 ontlaadt als afvalwarmte de totale energie vindt die wordt gegenereerd door in een periode van 30 dagen.
Een elektriciteitscentrale verbrandt kolen en genereert gemiddeld 610,0 MW elektrisch terwijl 963,80 ontlaadt als afvalwarmte de totale energie vindt die wordt gegenereerd door in een periode van 30 dagen.
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


