
Wetenschap
Waarom verlaagt NaCl het vriespunt van water met twee keer zoveel sucrose?
Point Point Depression
Bevriezende puntdepressie is een colligatieve eigenschap, wat betekent dat het afhankelijk is van het * aantal * van opgeloste stofdeeltjes in een oplossing, niet op de specifieke identiteit.
* meer deeltjes =grotere depressie: Hoe meer opgeloste deeltjes u toevoegt aan een oplosmiddel, hoe meer u het vermogen van het oplosmiddel verstoort om een vaste roosterstructuur te vormen, wat leidt tot een lager vriespunt.
Dissociatie versus niet-dissociatie
* NaCl: Wanneer NaCl oplost in water, dissocieert het * in twee ionen:Na+ en Cl-. Dit betekent dat één mol NaCl twee mol deeltjes in oplossing produceert.
* sucrose: Sucrose daarentegen is een moleculaire verbinding die * niet * in water dissocieert. Eén mol sucrose blijft als één mol deeltjes in oplossing.
De "van't hoff -factor"
De "van't hoff -factor" (i) verklaart het aantal deeltjes dat een opgeloste stof in oplossing produceert:
* i =1 voor niet-dissociatieve opgeloste stoffen zoals sucrose.
* i =2 voor NaCl (en andere ionische verbindingen die dissociëren in twee ionen).
De vergelijking
Het vriespuntdepressie (ATF) wordt berekend met behulp van de volgende vergelijking:
Δtf =i * kf * m
waar:
* KF is het vriespuntdepressieconstante voor het oplosmiddel (in dit geval water)
* M is de molaliteit van de oplossing (mol opgeloste stof per kilogram oplosmiddel)
Waarom niet precies twee keer?
Hoewel de "I" -factor voor NaCl 2 is en voor sucrose 1 is, is de werkelijke vriespuntdepressie misschien niet precies twee keer zoveel. Dit is waarom:
* ionische interacties: De ionen in NaCl -oplossing kunnen enkele interacties met elkaar hebben, waardoor hun effectieve aantal deeltjes wordt verminderd.
* concentratie -effecten: De depressie van het vriespunt wordt minder evenredig met de molaliteit bij hogere concentraties.
Samenvattend:
NaCl verlaagt het vriespunt van water meer dan sucrose omdat het dissocieert in twee deeltjes per formule -eenheid, terwijl sucrose blijft als één deeltje. De werkelijke depressie is echter mogelijk niet exact twee keer vanwege factoren zoals ionische interacties en concentratie -effecten.
 Wat is het vermogen van het ene materiaal om in het andere op te lossen?
Wat is het vermogen van het ene materiaal om in het andere op te lossen?  Waar wordt stikstofgas voor gebruikt?
Waar wordt stikstofgas voor gebruikt?  E. coli gebruiken om bioproducten te maken, zoals biodiesel, op een kosteneffectieve manier
E. coli gebruiken om bioproducten te maken, zoals biodiesel, op een kosteneffectieve manier Een vloeibare verbinding van waterstof en zuurstof?
Een vloeibare verbinding van waterstof en zuurstof?  Dogen vloeibare vlammen gemakkelijker ontbranden dan vloeistoframingen.
Dogen vloeibare vlammen gemakkelijker ontbranden dan vloeistoframingen.
 Om enquêtes en ander onderzoek te verbeteren, bestuderen entomologen hoe kleuren wilde bijen aantrekken
Om enquêtes en ander onderzoek te verbeteren, bestuderen entomologen hoe kleuren wilde bijen aantrekken  NASA ziet intensivering van Typhoon Lan hoog in de troposfeer
NASA ziet intensivering van Typhoon Lan hoog in de troposfeer Dodelijke moessonregenval in India gemeten met NASA's IMERG
Dodelijke moessonregenval in India gemeten met NASA's IMERG Nieuwe studie kan een revolutie teweegbrengen in de manier waarop we recyclen
Nieuwe studie kan een revolutie teweegbrengen in de manier waarop we recyclen Metingen voor kardinaal nestkastjes
Metingen voor kardinaal nestkastjes
Hoofdlijnen
- Wat het verschil tussen RNA en DNA in aantal strengen?
- Wat is nomothetisch?
- Is dit het begin van het einde van de plantenveredeling?
- De voor- en nadelen van mutatie
- Waarom zijn neuronen en spiercellen rijk aan mitochondriën?
- Wat is het somatische systeem?
- Moet je intelligent zijn om slecht te zijn?
- Wat maakt avocado’s eigenlijk slecht voor het milieu?
- Wat zijn twee soorten organismen in de stikstoffixatie?
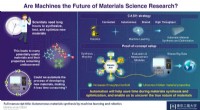
- Creativiteit bij onderzoekers stimuleren:hoe automatisering een revolutie teweeg kan brengen in materiaalonderzoek
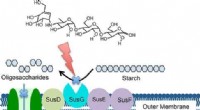
- Nauwkeurige targetingtechniek zou darmbacteriën kunnen reguleren, ziekte inperken
- Opruimen met cellulose
- Chemische synthese met kunstmatige intelligentie:onderzoekers ontwikkelen nieuwe computermethode
- Nieuwe stikstof-assemblage koolstofkatalysator heeft potentieel om chemische productie te transformeren

 Welk land produceert de meeste energie ter wereld?
Welk land produceert de meeste energie ter wereld?  Welke eigenschap van licht wordt gedemonstreerd door het potlood in glaswater?
Welke eigenschap van licht wordt gedemonstreerd door het potlood in glaswater?  Waar kan men de maan het duidelijkst zien in de nachtelijke hemel?
Waar kan men de maan het duidelijkst zien in de nachtelijke hemel?  Ontzag en angst:hoe religies door de eeuwen heen hebben gereageerd op totale zonsverduisteringen
Ontzag en angst:hoe religies door de eeuwen heen hebben gereageerd op totale zonsverduisteringen  Wat zijn de twee belangrijkste stadia van de meiose?
Wat zijn de twee belangrijkste stadia van de meiose?  Wat is de molaire massa natriumhypochloriet?
Wat is de molaire massa natriumhypochloriet?  Dieselbrandstof Home verwarmingsolie
Dieselbrandstof Home verwarmingsolie  De pandemie van het coronavirus vereist dat we de duistere toeleveringsketens van voedsel begrijpen
De pandemie van het coronavirus vereist dat we de duistere toeleveringsketens van voedsel begrijpen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

