
Wetenschap
Wat gebeurt er als zwavel brandt om dioxide te maken?
Hier is een uitsplitsing van het proces:
reactie:
* zwavel (s) + zuurstof (O2) → zwaveldioxide (SO2)
Wat gebeurt er:
1. verbranding: Zwavel reageert met zuurstofmoleculen in de lucht.
2. Energie -afgifte: Deze reactie geeft warmte en licht vrij, waardoor de zwavel verbrandt.
3. Vorming van zwaveldioxide: De zwavelatomen combineren met zuurstofatomen om zwaveldioxidemoleculen te vormen.
Eigenschappen van zwaveldioxide:
* kleurloos gas: Het is onzichtbaar voor het blote oog.
* scherpe geur: Het heeft een scherpe, verstikkende geur.
* giftig: Zwaveldioxide is een irriterende luchtwegen en kan schadelijk zijn voor de menselijke gezondheid.
* Acid Rain Precursor: Wanneer het in de atmosfeer wordt afgegeven, reageert zwaveldioxide met waterdamp om zwavelzuur te vormen, wat bijdraagt aan zure regen.
Praktische toepassingen:
* Industriële processen: Zwaveldioxide wordt gebruikt bij de productie van zwavelzuur, dat in veel industrieën een cruciaal ingrediënt is.
* Voedselbehoud: Het wordt gebruikt als een ontsmettingsmiddel en een conserveermiddel voor gedroogde groenten en fruit.
Het is belangrijk op te merken dat het verbranden van zwavel om zwaveldioxide te produceren een belangrijke bron van luchtvervuiling is. Daarom is het essentieel om zwavelemissies van industriële processen te minimaliseren en alternatieve methoden te vinden om zwavelzuur te produceren.
 Waarom hebben fluor en chloor vergelijkbare eigenschappen?
Waarom hebben fluor en chloor vergelijkbare eigenschappen?  Hoe zet een condensor gas om in vloeistof?
Hoe zet een condensor gas om in vloeistof?  Wanneer een waterstofatoom zijn elektron verliest, hoe veranderen de dichtheid en gewichtsverandering?
Wanneer een waterstofatoom zijn elektron verliest, hoe veranderen de dichtheid en gewichtsverandering?  Onderzoekers lopen voorop bij het ontwikkelen van machine learning-methoden voor chemische ontdekking
Onderzoekers lopen voorop bij het ontwikkelen van machine learning-methoden voor chemische ontdekking Welke compound is FE CO3 3?
Welke compound is FE CO3 3?
Hoofdlijnen
- Schooner water gekoppeld aan kleinere kokkels die jonger afsterven
- Langharige microben vernoemd naar Canadese band Rush
- Geen zoetekauw meer? De wetenschap schakelt het verlangen naar suiker bij muizen uit
- Wild, eetbaar en voedzaam:onderzoek en recepten onthullen de voordelen van regionale Turkse planten
- Welke organellen is de site voor fotosynthese?
- Onderzoekers bestuderen hoe stedelijke bomen het milieu beïnvloeden
- Waarom staat Linnaeus bekend als de vader van taxonomie?
- Gasachtige koeien zijn slecht voor de planeet; Kan een zeewierdieet helpen?
- Wat is een kenmerk van mitose en geen meiose?
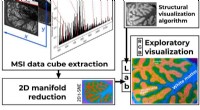
- Een nieuwe perceptueel consistente methode voor visualisatie van massaspectrometriebeeldvorming
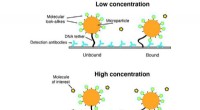
- Toekomstige biosensor voor continue monitoring met behulp van moleculaire lookalikes
- Acrylamide snijden in gefrituurde en gebakken snacks

- Een voorbeeld van plasmonen die rechtstreeks invloed hebben op moleculen

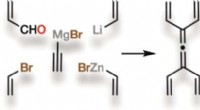
- Gespannen, symmetrisch, en nieuw:tetravinylalleen, een klein maar krachtig molecuul, is voor het eerst gesynthetiseerd
 Welke energietransformatie vindt plaats door handen te klappen?
Welke energietransformatie vindt plaats door handen te klappen?  Wie mag beslissen wat als ‘stoornis’ geldt?
Wie mag beslissen wat als ‘stoornis’ geldt?  Welk type wetenschapper past het beste bij het gebied dat zij zouden bestuderen?
Welk type wetenschapper past het beste bij het gebied dat zij zouden bestuderen?  Welke materialen absorberen de meest zonnestraling?
Welke materialen absorberen de meest zonnestraling?  Hoeveel atomen van H zijn er in 2 mol C8H18?
Hoeveel atomen van H zijn er in 2 mol C8H18?  Wat is 73,6 graden F in Celsius?
Wat is 73,6 graden F in Celsius?  Hoe batterijen werken
Hoe batterijen werken  Vader, zoon bereidt zich voor op zonsverduistering na gemiste bezichtiging in 1979
Vader, zoon bereidt zich voor op zonsverduistering na gemiste bezichtiging in 1979
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

