
Wetenschap
Heeft koolstof grotere atomen dan fluor?
Dit is waarom:
* Atomische straal: Atomaire straal is de afstand tussen de kern en de buitenste elektronenschil van een atoom. Fluor heeft een kleinere atoomradius dan koolstof.
* elektronegativiteit: Fluor is het meest elektronegatieve element, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen. Deze sterke aantrekkingskracht trekt de elektronen dichter bij de kern, waardoor de atomaire straal kleiner wordt.
* Nucleaire lading: Fluor heeft een hogere nucleaire lading (meer protonen in de kern) dan koolstof. Deze sterkere aantrekkingskracht trekt de elektronen dichter bij de kern, waardoor de atoomradius verder wordt verminderd.
Samenvattend is de kleinere atoomradius van fluor vergeleken met koolstof te wijten aan de hogere elektronegativiteit en sterkere nucleaire lading.
 Is magma een vloeibaar gas of vaste stof?
Is magma een vloeibaar gas of vaste stof?  Wat is de kristalstructuur van aluminium?
Wat is de kristalstructuur van aluminium?  Glycerine maken van plantaardige olie
Glycerine maken van plantaardige olie Welke juiste methode om de geur van een onbekende chemische stof te testen?
Welke juiste methode om de geur van een onbekende chemische stof te testen?  Wanneer de moleculen in een lichaam met verhoogde snelheid bewegen, is het mogelijk dat van gas naar vloeistof verandert?
Wanneer de moleculen in een lichaam met verhoogde snelheid bewegen, is het mogelijk dat van gas naar vloeistof verandert?
 Studie kijkt naar ijzer van microben voor klimaathulp
Studie kijkt naar ijzer van microben voor klimaathulp CO2-etikettering verkleint onze CO2-voetafdruk, zelfs voor degenen die proberen onwetend te blijven
CO2-etikettering verkleint onze CO2-voetafdruk, zelfs voor degenen die proberen onwetend te blijven Millennials en Generatie Z zijn meer gericht op duurzaamheid, zelfs als het om geld gaat, onderzoekers vinden
Millennials en Generatie Z zijn meer gericht op duurzaamheid, zelfs als het om geld gaat, onderzoekers vinden Ant-adaptatie
Ant-adaptatie  Wat betekent de betekenis van Onafhankelijkheidsverklaring?
Wat betekent de betekenis van Onafhankelijkheidsverklaring?
Hoofdlijnen
- Reproduceren alle levende wezens zich aseksueel?
- Uitleg:Wat is antimaterie?
- Wat combineert met elke helft van het DNA -molecuul?
- Omringd door zieke collega's? Je lichaam bereidt zich voor op de strijd
- Hersenonderzoek onthult hoe insecten de weg naar huis vinden
- Proces door welke fagocyten pathogenen vernietigen worden genoemd?
- Mitose in dierlijke cellen verschilt van de mitose -plant omdat?
- Wat is het eerste organisme in de aarde?
- Welke receptorcellen stellen ons het meest direct in staat om verschillende golflengten van licht te onderscheiden?
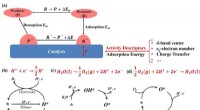
- Activiteitsbeschrijvingen voor elektrokatalysatoren in toepassingen voor energieopslag
- Deep learning en holografie creëren een betere point-of-care-sensor

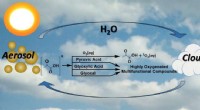
- Organische 2-oxocarbonzuren zorgen voor een link naar de vorming van radicalen en reactieve zuurstofsoorten in atmosferische deeltjes
- Onderzoekers creëren instrument om snel te testen of medicijnen sporenkristalliniteit bevatten

- Onderzoekers ontwikkelen een nieuwe manier om belangrijke biologische processen te bestuderen

 Wat is het erosie -deel van de continentale marge?
Wat is het erosie -deel van de continentale marge?  Wat zijn de twee verschillende soorten sterrenbeelden?
Wat zijn de twee verschillende soorten sterrenbeelden?  Giftige chemicaliën in zonnepanelen
Giftige chemicaliën in zonnepanelen  Sterke velden en ultrasnelle bewegingen - hoe elektronen in vloeibaar water te genereren en te sturen?
Sterke velden en ultrasnelle bewegingen - hoe elektronen in vloeibaar water te genereren en te sturen? Lang gezocht verval van Higgs-deeltje waargenomen
Lang gezocht verval van Higgs-deeltje waargenomen Wat is de naam van molecuul met deze atomaire configuratie CH3CH2CH2CH2CH3?
Wat is de naam van molecuul met deze atomaire configuratie CH3CH2CH2CH2CH3?  De voordelen en nadelen van OTEC
De voordelen en nadelen van OTEC Wat is dynamiet en hoe werkt het?
Wat is dynamiet en hoe werkt het?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

