
Wetenschap
Hoe werkt zwaveldioxide als een uitdrogingsmiddel?
$ So_2 (g) + h_2o (l) \ rightlefTharpoons h_2so_3 (aq) $
Deze reactie is omkeerbaar en resulteert niet noodzakelijkerwijs in het verwijderen van water uit een stof.
Dit is de reden waarom $ SO_2 $ niet wordt beschouwd als een typisch dehydraterende agent:
* omkeerbaarheid: De reactie met water is gemakkelijk omgekeerd, wat betekent dat het zwavelzuur terug kan ontleden tot $ SO_2 $ en water.
* zwak zuur: Zwavelzuur is een zwak zuur, waardoor het minder effectief is bij het verwijderen van water in vergelijking met sterke zuren zoals zwavelzuur.
* Beperkte reactiviteit: $ SO_2 $ reageert voornamelijk met water om zwavelzuur te vormen, maar het reageert niet gemakkelijk met andere verbindingen om water te verwijderen.
Hoewel $ SO_2 $ met water kan reageren, is het daarom geen primair uitdroging. Zijn rol in chemische reacties is meer gericht op zijn zure eigenschappen en zijn vermogen om in sommige gevallen als een reductiemiddel te fungeren.
 Hoe worden waterstof en zuurstof genoemd?
Hoe worden waterstof en zuurstof genoemd?  Wat is de chemische formule voor koolstof en zuurstof?
Wat is de chemische formule voor koolstof en zuurstof?  Kun je waterstofperoxide op piercings gebruiken?
Kun je waterstofperoxide op piercings gebruiken?  Welke atomen worden bij kernfusie gebruikt om helium te produceren met grotere massa's?
Welke atomen worden bij kernfusie gebruikt om helium te produceren met grotere massa's?  Een dubbele covalente chemische binding vertegenwoordigt het delen van hoeveel electdrons?
Een dubbele covalente chemische binding vertegenwoordigt het delen van hoeveel electdrons?
 Poll:Amerikanen wijten wild weer aan opwarming van de aarde
Poll:Amerikanen wijten wild weer aan opwarming van de aarde Nieuwe index laat zien dat door de mens veroorzaakte opwarming van de aarde sneller gaat dan ooit
Nieuwe index laat zien dat door de mens veroorzaakte opwarming van de aarde sneller gaat dan ooit Studie vindt het magnetisch veld van de aarde eenvoudiger dan we dachten
Studie vindt het magnetisch veld van de aarde eenvoudiger dan we dachten Wat zijn Inca Natural Resources?
Wat zijn Inca Natural Resources?  Ideeën voor wetenschapsbeurs voor vijfde leerjaar
Ideeën voor wetenschapsbeurs voor vijfde leerjaar
Hoofdlijnen
- Wat is het resultaat van catalasetest voor Streptomyces?
- Hoeveel cellen hebben levende wezens?
- Wat zijn de 3 belangrijkste soorten RNA?
- Evolutie in actie? Nieuwe studie vindt de mogelijkheid van stikstofbindende organellen
- Wat is mutualisme van een pinguïn?
- De intracellulaire omgeving kan het beste worden beschreven als?
- Uit afvalwatermodellering van landbouwbedrijven blijkt dat voetbaden een bron van antimicrobiële resistentie zijn
- Het lichaam over zeer efficiënte interne afweermechanismen beschikt die elke hoeveelheid ongewenste stoffen kunnen verwijderen?
- Ontdekking van aminozuur onthult hoe licht huidmondjes in planten open maakt
- UV-licht van de zon hielp het leven te vonken

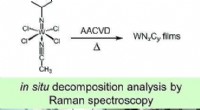
- Gesimuleerde chemische dampafzetting van een wolfraamcarbonitride-precursor
- Zelfherstellende batterijen:ingenieurs ontwikkelen een manier om batterijen met een hoge capaciteit en een lange levensduur te maken

- Aroma's detecteren in oude cognac

- Extreem sterke en toch ongelooflijk ductiele meercomponentenlegeringen ontwikkeld

 Wat is het samenstellende element van natrium?
Wat is het samenstellende element van natrium?  Gesprayde tactiele sensor op een 3D-oppervlak voor robothuid
Gesprayde tactiele sensor op een 3D-oppervlak voor robothuid Welk type organisme zou in de meeste ecosystemen het minst overvloedig aanwezig zijn?
Welk type organisme zou in de meeste ecosystemen het minst overvloedig aanwezig zijn?  Een theoretisch pad naar gepolariseerde elektronenstraal-nanospectroscopie
Een theoretisch pad naar gepolariseerde elektronenstraal-nanospectroscopie Waarom wordt de brosheidstester ingesteld op 100 revoluties?
Waarom wordt de brosheidstester ingesteld op 100 revoluties?  Wat zijn de methoden voor waterzuivering?
Wat zijn de methoden voor waterzuivering?  Colorados Lake Dillon warmt snel op
Colorados Lake Dillon warmt snel op Geef de beren geen eten! Hoe parken ervoor zorgen dat bezoekers de natuur beschermen
Geef de beren geen eten! Hoe parken ervoor zorgen dat bezoekers de natuur beschermen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

