
Wetenschap
Wat gebeurt er als zink en zuurstof combineren?
Hier is een uitsplitsing van wat er gebeurt:
* zink (Zn) is een metaal dat relatief reactief is.
* zuurstof (O2) is een zeer reactief gas.
* Wanneer zink wordt blootgesteld aan zuurstof, reageren de zuurstofatomen met de zinkatomen.
* Elk zinkatoom verliest twee elektronen om A zinkion (Zn²⁺) te vormen .
* Elk zuurstofmolecuul krijgt vier elektronen om twee oxide -ionen (o²⁻) te vormen .
* Deze ionen combineren vervolgens om zinkoxide (ZnO) te vormen , een witte vaste stof.
De chemische vergelijking voor deze reactie is:
2 Zn + O2 → 2 ZnO
eigenschappen van zinkoxide:
Zinkoxide is een wit, geurloos poeder dat op grote schaal wordt gebruikt in verschillende industrieën, waaronder:
* Verf en coatings voor zijn pigment en beschermende eigenschappen
* Cosmetics als een zonnebrandcrème en ontstekingsremmende middel
* rubberindustrie als een versterking en vulkaniserende agent
* geneeskunde voor zijn antibacteriële en antischimmelige eigenschappen
Opmerking:
De reactie tussen zink en zuurstof kan optreden bij kamertemperatuur, maar deze wordt versneld door warmte. Wanneer zink wordt verwarmd in aanwezigheid van zuurstof, brandt het met een heldere, witte vlam, die zinkoxide produceert als een witte rook.
 Welk type antimicrobriaal middel werkt voor ampicilline?
Welk type antimicrobriaal middel werkt voor ampicilline?  Groep 1 metalen reageren met water om metaalhydroxiden te produceren en?
Groep 1 metalen reageren met water om metaalhydroxiden te produceren en?  Welk type transport wordt gebruikt om een molecuul uit de lage concentratie van de regio te verplaatsen?
Welk type transport wordt gebruikt om een molecuul uit de lage concentratie van de regio te verplaatsen?  Wat buigt en strekt zich uit in spectroscopie ir nmr?
Wat buigt en strekt zich uit in spectroscopie ir nmr?  Wat is het verschil tussen blauw en rood lakmoespapier?
Wat is het verschil tussen blauw en rood lakmoespapier?
 Nieuw boek laat zien hoe het oude Griekse schrift ons helpt de huidige milieucrises te begrijpen
Nieuw boek laat zien hoe het oude Griekse schrift ons helpt de huidige milieucrises te begrijpen  Studie kwantificeert de effectiviteit van ecologisch herstel op de uitstoot van broeikasgassen
Studie kwantificeert de effectiviteit van ecologisch herstel op de uitstoot van broeikasgassen  Hydrologie data tool helpt gebruikers bij het beheren van waterbronnen, infrastructuur beschermen
Hydrologie data tool helpt gebruikers bij het beheren van waterbronnen, infrastructuur beschermen Pesticiden gevonden in meer dan 80% van de geteste Europese bodems
Pesticiden gevonden in meer dan 80% van de geteste Europese bodems Is het de moeite waard om de meest fervente klimaatontkenners te overtuigen?
Is het de moeite waard om de meest fervente klimaatontkenners te overtuigen?
Hoofdlijnen
- Waarom worden sommige enzymen hydrolytisch enzym genoemd?
- Welke term wordt gebruikt om organismen te beschrijven die dezelfde vorm van eigenschap passeren?
- Wat is een andere vorm van transport die eiwitten gebruikt om andere ionen en kleine moleculen over het plasmamembraan te verplaatsen?
- De verschillen in broederlijke en vaderlijke tweelingen
- Wat zijn de drie belangrijkste sekten van hersenen?
- Het feit dat een nakomelingen niet identiek zijn, staat bekend als?
- Wat zijn de twee belangrijke variabelen in een onderzoekstitel?
- Welke rol spelen lipidemoleculen bij het semipermeabel maken van het celmembraan?
- Wetenschappers ontwikkelen een computervisieframework om dieren in het wild te volgen zonder markeringen
- Ahard kijken naar polymeren in cementmix
- Nieuw, goedkoop alternatief voor ethyleenproductie
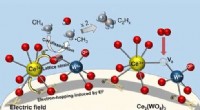
- Studie richt zich op LigM vanwege zijn rol bij het afbreken van aromatische verontreinigende stoffen

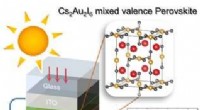
- Loodvrij, efficiënte perovskiet voor fotovoltaïsche cellen
- Techniek om keramische films te fabriceren voor OPV-tussenlagen

 Hoe werkt een liniaal?
Hoe werkt een liniaal?  Hoe is Sun de ultieme bron van biomassa?
Hoe is Sun de ultieme bron van biomassa?  Bewijs dat malafide golven extremer worden
Bewijs dat malafide golven extremer worden Achtervolgt de Bunyip echt de Australische Wetlands?
Achtervolgt de Bunyip echt de Australische Wetlands?  Waarom zou je geen sedimentaire rotsen op de maan vinden?
Waarom zou je geen sedimentaire rotsen op de maan vinden?  Waarom gebruiken mensen nog steeds faxmachines?
Waarom gebruiken mensen nog steeds faxmachines? De pagina omslaan:Japans laatste semafoondienst eindigt na 50 jaar
De pagina omslaan:Japans laatste semafoondienst eindigt na 50 jaar Wat is een massa van een mineraal in rots of de grond?
Wat is een massa van een mineraal in rots of de grond?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

