
Wetenschap
Kan koolstof koppelen aan zichzelf en andere elementen vormen zeer grote moleculaire structuren?
* Sterke koolstof-koolstofbindingen: Koolstof vormt sterke covalente bindingen met zichzelf, waardoor lange ketens, vertakte structuren en zelfs ringen ontstaan. Deze bindingen zijn sterk en stabiel, waardoor de vorming van grote moleculen mogelijk is.
* Vier valentie -elektronen: Koolstof heeft vier valentie -elektronen, wat betekent dat het vier bindingen kan vormen. Dit zorgt voor uitgebreide vertakkings- en bindingsmogelijkheden, wat leidt tot zeer complexe structuren.
* Mogelijkheid om te binden met andere elementen: Koolstof bindt gemakkelijk met andere elementen zoals waterstof, zuurstof, stikstof en zwavel. Deze diversiteit draagt bij aan de complexiteit en functionaliteit van de resulterende moleculen.
Voorbeelden van grote structuren op basis van koolstof:
* polymeren: Plastic, eiwitten, koolhydraten en DNA zijn allemaal voorbeelden van polymeren, die lange ketens zijn van herhalende monomeereenheden. Deze moleculen zijn essentieel voor het leven en tal van industriële toepassingen.
* grafeen: Een enkele laag koolstofatomen gerangschikt in een zeshoekig rooster, grafeen is een ongelooflijk sterk en geleidend materiaal met divers potentieel gebruik.
* fullerenes: Deze kooiachtige koolstofstructuren, zoals BuckminsterFullerene (C60), hebben unieke eigenschappen en vinden toepassingen op verschillende gebieden.
Samenvattend:
Met de unieke bindingseigenschappen van koolstof kan het een ongelooflijke diversiteit vormen van grote en complexe moleculaire structuren. Dit vermogen is de basis van organische chemie en is verantwoordelijk voor het grote scala aan materialen en biologische moleculen die onze wereld vormen.
 Temperatuur, zonnestraling, wind-parameters om de luchttemperatuur van een voertuig in de cabine te voorspellen
Temperatuur, zonnestraling, wind-parameters om de luchttemperatuur van een voertuig in de cabine te voorspellen NASA vindt een asymmetrische tropische storm Barry
NASA vindt een asymmetrische tropische storm Barry Zal het benoemen van het Antropoceen leiden tot acceptatie van onze impact op planeetniveau?
Zal het benoemen van het Antropoceen leiden tot acceptatie van onze impact op planeetniveau? Ansjovis eet plastic omdat het naar prooi ruikt
Ansjovis eet plastic omdat het naar prooi ruikt Bijgewerkte kaartgegevenssets voor Antarctica
Bijgewerkte kaartgegevenssets voor Antarctica
Hoofdlijnen
- Om de hypothese te testen, moet een wetenschapper?
- Hoe komen wetenschappers tegenwoordig uit of twee organismen gerelateerd zijn?
- Verdeelt meiose geslachtscellen en lichaamscellen?
- Wat gebeurt er met de structuren in kern elke fase profase plus?
- In Vietnam verminderen boeren de methaanuitstoot door de manier waarop ze rijst verbouwen te veranderen
- Bacterieel 'schakelgen' reguleert hoe oceanen zwavel in de atmosfeer uitstoten
- Cellen uit de vroege aarde zijn gemodelleerd om te laten zien hoe eerste levensvormen RNA zouden kunnen hebben verpakt
- Op AI gebaseerde screeningmethode zou de snelheid van nieuwe geneesmiddelenontdekking kunnen verhogen
- Wat is de betekenis van ATP en waarom het belangrijk is voor het leven?
- Manipuleren van ketenlopen in olefinen met behulp van aarde-overvloedige op ijzer gebaseerde katalysatoren
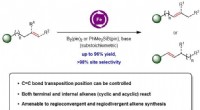
- Kenniskloof gedicht in ons begrip van degradatie van ethaan
- Een nieuwe strategie om koolstofnitride-fotokatalysatoren voor stikstofreductie te stabiliseren

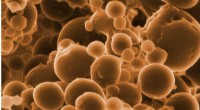
- Bacteriën eten broeikasgas met een kant van eiwit

- snel, flexibele wateranalyse zorgt voor opschudding in de industrie

 Wat zou bij kamertemperatuur de zachtste lipiden opleveren?
Wat zou bij kamertemperatuur de zachtste lipiden opleveren?  Welke atoomorbitalen bevatten in een broomatoom de valentie -elektronen?
Welke atoomorbitalen bevatten in een broomatoom de valentie -elektronen?  Wat is de levensverwachting van landschapsverlichting op zonne-energie?
Wat is de levensverwachting van landschapsverlichting op zonne-energie?  Welke sterren hebben de hoogste oppervlaktetemperaturen rode ster of blauwe sterren?
Welke sterren hebben de hoogste oppervlaktetemperaturen rode ster of blauwe sterren?  Welke planeten worden gevormd uit overgebleven vorming van de zon in de middenwolk?
Welke planeten worden gevormd uit overgebleven vorming van de zon in de middenwolk?  Is koper een monoatomisch moleculair of roosterelement?
Is koper een monoatomisch moleculair of roosterelement?  Wat is de reden voor cirkelvormige bewegingen rond de aarde?
Wat is de reden voor cirkelvormige bewegingen rond de aarde?  Wat zijn tactische kernwapens? Veiligheidsexpert legt uit en beoordeelt wat ze betekenen voor de oorlog in Oekraïne
Wat zijn tactische kernwapens? Veiligheidsexpert legt uit en beoordeelt wat ze betekenen voor de oorlog in Oekraïne
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

