
Wetenschap
Waarom heeft aluminium meestal een oxidatietoestand van 3?
* Elektronische configuratie: Aluminium heeft een atoomnummer van 13, met een elektronische configuratie van [NE] 3S² 3P¹. Dit betekent dat het drie elektronen in zijn buitenste schaal heeft.
* De neiging om elektronen te verliezen: Metalen verliezen de neiging elektronen te verliezen om een stabiele, edelgasconfiguratie te bereiken. Aluminium kan dit bereiken door zijn drie valentie -elektronen te verliezen, waardoor het een volledige buitenste schaal achterlaat (zoals neon, dat is een edelgas).
* Vorming van Al³⁺: Wanneer aluminium drie elektronen verliest, vormt het een positief geladen ion, al³⁺. Dit ion is zeer stabiel omdat het een complete buitenste schaal van elektronen heeft.
* ionische binding: De Al³⁺ -ion vormt gemakkelijk ionische bindingen met niet -metalen, die de neiging hebben om elektronen te winnen. Dit resulteert in de vorming van verbindingen zoals aluminiumoxide (al₂o₃) en aluminiumchloride (ALCL₃).
Samenvattend: De neiging van aluminium om drie elektronen te verliezen om een stabiele edelgasconfiguratie te bereiken en zijn vermogen om stabiele ionische bindingen te vormen met niet -metalen leidt tot de meest voorkomende oxidatietoestand van +3.
Hoofdlijnen
- Noem de ziekte waar bloedcellen niet genoeg zuurstof dragen?
- Wat zijn de vier theorieën over ziekteveroorzaak?
- Hoe babyvissen een thuis vinden
- Wat is de wetenschappelijke classificatie van aerobe bacteriën?
- Hoe zuurstofgas wordt geproduceerd tijdens fotosynthese?
- Menselijke activiteit maakt het voor wetenschappers moeilijker om oceanen uit het verleden te interpreteren
- Hoeveel stands zijn er in DNA?
- Wat doet een twiner van STEM?
- Welke regels moet je volgen als wetenschapper?
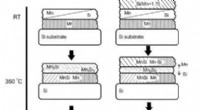
- Natuurkundigen houden toezicht op de vorming van hogere mangaansilicidefilms
- Experimenten op afstand tonen de waarde van wereldwijde verbindingen tijdens de pandemie

- Multifunctionele poreuze geleidende membranen helpen microben zich een weg te banen naar een snellere omzetting van kooldioxide
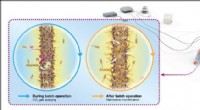
- Batterijprestaties beoordelen:in vergelijking met wat?

- Gecombineerde databenadering kan de ontwikkeling van nieuwe materialen versnellen
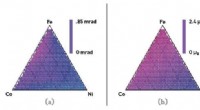
 Wat zijn de voorbeelden van cementiet?
Wat zijn de voorbeelden van cementiet?  Wetenschappers ontwikkelen unieke materialen om beschadigde organen en weefsels te herstellen
Wetenschappers ontwikkelen unieke materialen om beschadigde organen en weefsels te herstellen Hoe winkeldieven diefstal bij zelfbedieningskassa's van supermarkten rechtvaardigen
Hoe winkeldieven diefstal bij zelfbedieningskassa's van supermarkten rechtvaardigen Waarom zijn er volgens de Griekse mythologie verschillende seizoenen?
Waarom zijn er volgens de Griekse mythologie verschillende seizoenen?  Ingenieurs lossen datastoring op NASA's Voyager 1 op
Ingenieurs lossen datastoring op NASA's Voyager 1 op Hoe verhoudt macht zich tot geweld?
Hoe verhoudt macht zich tot geweld?  Wat is de naam van deze samengestelde PCI3?
Wat is de naam van deze samengestelde PCI3?  Uit onderzoek blijkt dat het minimum aantal kolonisten op Mars om te overleven 110 is
Uit onderzoek blijkt dat het minimum aantal kolonisten op Mars om te overleven 110 is
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


