
Wetenschap
Wat zijn de chemische eigenschappen van Neon?
chemische eigenschappen van neon:
Neon is een edelgas, wat betekent dat het extreem niet -reactief is en niet gemakkelijk chemische bindingen vormt. Dit komt door de stabiele elektronenconfiguratie met een volledige buitenschaal. Hier zijn enkele belangrijke chemische eigenschappen van neon:
1. Inertheid: Neon is het tweede minst reactieve element, alleen overtroffen door helium. Het vormt geen stabiele chemische verbindingen onder normale omstandigheden.
2. Gebrek aan oxidatietoestanden: Vanwege de inerte aard vertoont Neon geen oxidatietoestanden.
3. Geen reactiviteit met andere elementen: Neon reageert niet met andere elementen om verbindingen te vormen.
4. Geen ionisatie: Neon vormt niet gemakkelijk ionen vanwege de stabiele elektronenconfiguratie.
5. Afwezigheid van conventionele chemische binding: Neon neemt niet deel aan covalente of ionische binding met andere elementen.
6. Zwakke Vander Waals Forces: Neon vertoont alleen zwakke Vander Waals -krachten tussen zijn atomen, die bijdragen aan het lage kookpunt en de gasvormige toestand bij kamertemperatuur.
7. Beperkte chemische reacties: Hoewel het neon bekend is als inert, zijn er enkele meldingen geweest van de deelname aan een paar zeer ongebruikelijke reacties onder extreme omstandigheden, zoals het vormen van onstabiele ionische soorten in een plasmasaat. Deze zijn echter uiterst zeldzaam en beperkt.
8. Geen biologische rol: Neon heeft geen bekende biologische rol.
Over het algemeen worden de chemische eigenschappen van neon gedomineerd door de inerte aard, waardoor het een zeer stabiel element is met beperkte chemische interacties. Deze eigenschap maakt het nuttig in verschillende toepassingen, zoals verlichting, lasers en cryogenica.
 De strijd tegen luchtvervuiling is cruciaal voor de volksgezondheid in China, studie zegt:
De strijd tegen luchtvervuiling is cruciaal voor de volksgezondheid in China, studie zegt: Waarom bliksem vaak twee keer inslaat:onderzoek onthult naaldachtige structuren in positief geladen bliksemleiders
Waarom bliksem vaak twee keer inslaat:onderzoek onthult naaldachtige structuren in positief geladen bliksemleiders De delicate waterlelie:een roos met een andere naam?
De delicate waterlelie:een roos met een andere naam?  Filippijnse vulkaan komt weer tot leven, duizenden geëvacueerd
Filippijnse vulkaan komt weer tot leven, duizenden geëvacueerd Tornado-waarschuwingen geven een pad om voorspellingen te verbeteren
Tornado-waarschuwingen geven een pad om voorspellingen te verbeteren
Hoofdlijnen
- Wat is er tussen cellen?
- Hoe kankerverwekkende papillomavirussen evolueerden
- Wat scheiden elke spijsverteringsklier af?
- Psychologische theorie over de vijf menselijke zintuigen
- Wanneer wetenschappers objecten groeperen volgens hun kenmerken, wordt dit proces genoemd?
- Nieuwe oude dolfijnsoort Urkudelphis chawpipacha ontdekt in Ecuador
- Plantwetenschappelijk onderzoek maakt de weg vrij voor een beter begrip van de werking van het immuunsysteem van planten
- Een groep cellen die een bepaalde functie uitvoert, wordt A genoemd?
- Behoud oproep aan zaagviskwekerij
- Nieuwe carbon dot-gebaseerde methode om de efficiëntie van zonnecellen en leds te verhogen

- Hydrogels met periodiek patroon:een model voor coöperatieve vervorming
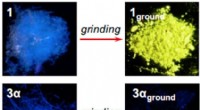
- Goudverbinding verschuift van een zichtbare fluorescentie naar het uitzenden van infrarood wanneer het wordt geaard
- Onderzoekers proberen dunnefilmtransistors met metaaloxiden te printen op warmtegevoelige materialen

- Parfummakers zoeken natuurlijke, duurzame geuren

 Feiten over vervuiling door plastic zak
Feiten over vervuiling door plastic zak  Hoe permeabel is basalt?
Hoe permeabel is basalt?  Wat is een grote korstlaag die beweegt als één eenheid?
Wat is een grote korstlaag die beweegt als één eenheid?  Hoe raciale vooroordelen de internettoegang voor gekleurde mensen kunnen beperken
Hoe raciale vooroordelen de internettoegang voor gekleurde mensen kunnen beperken  Hoe noem je een wetenschapper die weefsels studeert?
Hoe noem je een wetenschapper die weefsels studeert?  Project zoekt duurzame blauwdruk voor waterkrachtdammen
Project zoekt duurzame blauwdruk voor waterkrachtdammen Is cavia -DNA en menselijk identiek?
Is cavia -DNA en menselijk identiek?  Welk element wordt gebruikt in vuurwerk en medicijnen een alkalisch aardmetaal?
Welk element wordt gebruikt in vuurwerk en medicijnen een alkalisch aardmetaal?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

