
Wetenschap
Waarom leidt zwavel geen elektriciteit?
* Geen gratis elektronen: Zwavelatomen hebben een volledige buitenste schaal van elektronen (6 elektronen). Ze zijn strak gebonden in het molecuul en worden niet gemakkelijk bevrijd om een elektrische stroom te dragen.
* Covalente binding: Zwavel bestaat als een vaste stof met een complexe moleculaire structuur. Deze moleculen worden bij elkaar gehouden door sterke covalente bindingen, waarbij elektronen tussen atomen worden gedeeld. Dit delen betekent dat de elektronen gelokaliseerd zijn en niet vrij om te bewegen.
* Gap met grote band: Zwavel heeft een grote bandafstand, wat betekent dat een grote hoeveelheid energie nodig is om een elektron te opwinden van de valentieband (waar elektronen normaal gesproken zich bevinden) naar de geleidingsband (waar elektronen vrij kunnen bewegen).
daarentegen hebben goede elektrische geleiders zoals koper:
* gratis elektronen: Ze hebben een enkel elektron in hun buitenste schaal, die gemakkelijk wordt bevrijd om een elektrische stroom te dragen.
* Metallic binding: Ze hebben een zee van gedelokaliseerde elektronen, waardoor een gemakkelijke beweging van lading mogelijk is.
* Gap met kleine band: Ze hebben een gat met kleine band en vereisen minder energie om elektronen in de geleidingsband te opwinden.
Daarom maken Sulphur's gebrek aan vrije elektronen, sterke covalente binding en grote band gap het een slechte geleider van elektriciteit.
 Welk deel van een atoom speelt een belangrijke rol bij chemische reacties?
Welk deel van een atoom speelt een belangrijke rol bij chemische reacties?  Onderzoekers kijken naar de natuur om de geheimen van cyclische imine-splitsing te ontrafelen
Onderzoekers kijken naar de natuur om de geheimen van cyclische imine-splitsing te ontrafelen Koperdraad wordt in een oplossing van zilvernitraat geplaatst. Kristallen vormen. Waarom laat het blauw en hoe laat je die redox -reactie zien?
Koperdraad wordt in een oplossing van zilvernitraat geplaatst. Kristallen vormen. Waarom laat het blauw en hoe laat je die redox -reactie zien?  Wat zijn alle koolwaterstoffen en hun derivaten?
Wat zijn alle koolwaterstoffen en hun derivaten?  Is chlorofluorocarbon oplosbaar in water, vervuilt het water?
Is chlorofluorocarbon oplosbaar in water, vervuilt het water?
 Faience in het oude Egypte
Faience in het oude Egypte  Organische deeltjes moduleren de roetvermenging in de atmosfeer
Organische deeltjes moduleren de roetvermenging in de atmosfeer Hoe klimaatverandering nieuwe epidemieën aan het licht zou kunnen brengen
Hoe klimaatverandering nieuwe epidemieën aan het licht zou kunnen brengen  Hoe je kleding microvezelvervuiling in de zee wordt
Hoe je kleding microvezelvervuiling in de zee wordt Het riooldistrict van Chicago waarschuwt tuinders niet gratis slib bevat voor altijd giftige chemicaliën
Het riooldistrict van Chicago waarschuwt tuinders niet gratis slib bevat voor altijd giftige chemicaliën
Hoofdlijnen
- Werken onze visserijwetten? Vraag maar naar gag grouper
- Kan er een cel in de cel zijn?
- Wat is een systeem in de wetenschap?
- De vogel heeft bruine vlekken op zijn vleugels is een voorbeeld van gevolgtrekking?
- Aan vuur aangepaste insecten maken optimaal gebruik van door bosbranden gesteriliseerde broedplaatsen
- Morfogenese in planten is het gevolg van wat?
- Wat is de trotosfeer?
- Onthulling van de geheimen van Montesinhos-honing:een mix van traditie en wetenschap
- Als een cel het eerste niveau van organisatie is in Living Things Fourth is?
- Onderzoekers beschrijven structuren, mechanismen die bacteriën in staat stellen antibiotica te weerstaan

- Nieuwe inkjetprintmethode kan het ontdekken van medicijnen en geprinte gepersonaliseerde medicijnafgifte versnellen

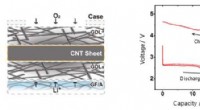
- Ontwikkeling van lithium-luchtbatterijen met ultrahoge capaciteit met behulp van CNT-blad-luchtelektroden
- Vloeistof-vloeistofovergangen kristalliseren nieuwe ideeën voor moleculaire vloeistoffen

- Wetenschappers bereiken de eerste stabiele simulaties van DNA-kristallen
 Betekent een natte zomer een briljante herfst?
Betekent een natte zomer een briljante herfst?  Waarom wordt een schakelaar gebruikt in het elektrische circuit?
Waarom wordt een schakelaar gebruikt in het elektrische circuit?  Opwarming van de aarde:meer insecten, meer gewassen eten
Opwarming van de aarde:meer insecten, meer gewassen eten Welke ruimtevaartuigen of robots verkenden Neptunus en welke jaren?
Welke ruimtevaartuigen of robots verkenden Neptunus en welke jaren?  Toekomstige astronauten kunnen genieten van verse groenten vanuit een autonome orbitale kas
Toekomstige astronauten kunnen genieten van verse groenten vanuit een autonome orbitale kas Problemen bij het polijsten van malachiet
Problemen bij het polijsten van malachiet  Nieuwe studie biedt kaarten, ice favorability index voor bedrijven die op zoek zijn naar mijnen op de maan
Nieuwe studie biedt kaarten, ice favorability index voor bedrijven die op zoek zijn naar mijnen op de maan EU betreurt de intrekking van het klimaatpact van de VS in Parijs ten zeerste
EU betreurt de intrekking van het klimaatpact van de VS in Parijs ten zeerste
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

