
Wetenschap
Wat is de formule van de tweede verbinding als twee oxiden een metaal respectievelijk 27,6 procent en 30 zuurstof bevatten als eerste M3O4?
Inzicht in het probleem
We hebben twee metaaloxiden. Het eerste oxide heeft de formule M₃o₄, waarbij M het metaal vertegenwoordigt. We kennen het percentage zuurstof in beide oxiden. We moeten de formule van het tweede oxide vinden.
stappen
1. Bepaal de molaire massa van het metaal in het eerste oxide:
* Laat de molaire massa van het metaal (m) 'x' zijn.
* De molaire massa van m₃o₄ =3x + (4 * 16) =3x + 64
* Percentage zuurstof in m₃o₄ =(64 / (3x + 64)) * 100 =27.6
* Los op voor 'x':6400 =82.8x + 1769.6
* 4630.4 =82.8x
* x ≈ 55.8
2. Bepaal de empirische formule van het tweede oxide:
* Het tweede oxide bevat 30% zuurstof per massa.
* Dit betekent dat als we een 100 g monster aannemen, er 30 g zuurstof en 70 g van het metaal zijn.
* Converteer gram in mollen:
* Mol zuurstof =30 g / 16 g / mol =1.875 mol
* Mol metaal =70 g / 55.8 g / mol ≈ 1,25 mol
* Verdeel de mol van elk element door het kleinste aantal mol om de eenvoudigste gehele getalverhouding te vinden:
* O:1.875 / 1.25 =1.5
* M:1,25 / 1.25 =1
* Omdat we geen fractionele subscripts kunnen hebben, vermenigvuldig je beide met 2 om hele getallen te krijgen:
* O:3
* M:2
De formule van het tweede oxide
De formule van het tweede oxide is m₂o₃ .
 Onderzoekers ontrafelen mysteries van de binnenste kern van de aarde
Onderzoekers ontrafelen mysteries van de binnenste kern van de aarde Moet Ierland zijn elektriciteitscentrales van brandstof voorzien met hout dat uit Australië wordt verscheept?
Moet Ierland zijn elektriciteitscentrales van brandstof voorzien met hout dat uit Australië wordt verscheept? Het vastleggen en opslaan van koolstof in de bodem:is het echt mogelijk om op te schalen?
Het vastleggen en opslaan van koolstof in de bodem:is het echt mogelijk om op te schalen?  Hebben bodembedekkingsgewassen een negatieve invloed op rijgewassen?
Hebben bodembedekkingsgewassen een negatieve invloed op rijgewassen?  Wat zijn onderwerpen in de natuurwetenschappen?
Wat zijn onderwerpen in de natuurwetenschappen?
Hoofdlijnen
- Het specifieke gehoororgaan wordt genoemd?
- Wat zijn enzymen die de hydrolyse van vetten versnellen?
- Wat neemt materialen in en uit een cel?
- Hoe DNA-bewijs werkt
- Structurele kenmerken van blauwgroene algen
- Welk wetenschappelijk woord begint met Z?
- Wat is genrunds?
- Welke dosis genetisch uniform betekent?
- Onderzoekers onthullen hoe genetisch identieke watervlooien zich ontwikkelen tot verschillende geslachten
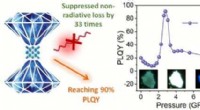
- Het bereiken van 90% PL-kwantumopbrengst in 1-D metaalhalogenide door drukonderdrukt niet-stralingsverlies
- Natuurkundigen werpen röntgenlicht op smeltende polymeren

- Een nieuw verband tussen glucose- en lipidenregulatie in het kankermetabolisme
- Nieuwe route naar CO2-neutrale brandstoffen uit kooldioxide ontdekt

- Discovery wijst de weg naar betere en goedkopere transparante geleiders
 Wat is een turbine en hoe produceert deze elektriciteit?
Wat is een turbine en hoe produceert deze elektriciteit?  Hoeveel versterkers van 3000 Watt op 220Volt AC enkele fase?
Hoeveel versterkers van 3000 Watt op 220Volt AC enkele fase?  Waarom is het belangrijk om in een goed geventileerd gebied te zijn wanneer de verbrandingsreactie plaatsvindt?
Waarom is het belangrijk om in een goed geventileerd gebied te zijn wanneer de verbrandingsreactie plaatsvindt?  Is lichte energie een grondstof of eindproduct?
Is lichte energie een grondstof of eindproduct?  Is de wetenschap het best gedefinieerd als een hoeveelheid kennis waar of onwaar?
Is de wetenschap het best gedefinieerd als een hoeveelheid kennis waar of onwaar?  Wat is de monomeer of subeenheid van koolhydraatstructuur?
Wat is de monomeer of subeenheid van koolhydraatstructuur?  Hoe snelheid te vinden van massa en lengte
Hoe snelheid te vinden van massa en lengte  Ontwerpen van een mobiele app die in realtime de visserijactiviteit van vaartuigen identificeert
Ontwerpen van een mobiele app die in realtime de visserijactiviteit van vaartuigen identificeert
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

