
Wetenschap
Waarom heeft zwaveldhexafluoride een laag kookpunt?
* Strong London Dispersion Forces: SF6 is een groot molecuul met een hoog molecuulgewicht. De grote elektronenwolk creëert sterke tijdelijke dipolen, wat leidt tot belangrijke dispersietroepen in Londen. Deze krachten zijn de primaire intermoleculaire interacties in SF6.
* Niet -polaire aard: SF6 is een niet -polair molecuul vanwege de symmetrische octaëdrische vorm. Dit betekent dat het dipool-dipool interacties mist, die meestal sterker zijn dan dispersiekrachten in Londen.
* Hoog molecuulgewicht: Het hoge molecuulgewicht van SF6 (146 g/mol) draagt bij aan de sterke dispersiekrachten in Londen.
Over het algemeen resulteert de combinatie van sterke dispersiekrachten in Londen en de niet -polaire aard ervan in een relatief hoog kookpunt voor SF6 (ongeveer -64 ° C).
Het is belangrijk op te merken dat hoewel SF6 een hoog kookpunt heeft in vergelijking met veel andere gassen zoals helium of stikstof, het nog steeds wordt beschouwd als een gas bij kamertemperatuur.
 Wat vertoont gassen lage dichtheden over de afstand tussen gasdeeltjes?
Wat vertoont gassen lage dichtheden over de afstand tussen gasdeeltjes?  Groene eiwitten maken uit de lucht
Groene eiwitten maken uit de lucht Wat is het proces van warmteoverdracht door een metaal?
Wat is het proces van warmteoverdracht door een metaal?  Welk type binding zal zich vormen tussen broom en broom?
Welk type binding zal zich vormen tussen broom en broom?  Onderzoekers verkrijgen veelbelovende resultaten voor de beheersing van verontreinigende stoffen in water
Onderzoekers verkrijgen veelbelovende resultaten voor de beheersing van verontreinigende stoffen in water
 Hoe beïnvloedt de natuurlijke omgeving de menselijke activiteit op een sneeuweiland?
Hoe beïnvloedt de natuurlijke omgeving de menselijke activiteit op een sneeuweiland?  OMG, de wateren warm! NASA-studie lost gletsjerpuzzel op
OMG, de wateren warm! NASA-studie lost gletsjerpuzzel op Bossen kunnen tegen 2050 van CO2-put naar bron veranderen
Bossen kunnen tegen 2050 van CO2-put naar bron veranderen Wat gebruikt bekende ideeën om onbekende feiten in de natuur te verklaren?
Wat gebruikt bekende ideeën om onbekende feiten in de natuur te verklaren?  De aanpassingen van schildpadden
De aanpassingen van schildpadden
Hoofdlijnen
- Wat is de functie van een embryo in een zaadje?
- Mediterrane potvissen vertonen grote variaties in grootte
- Bevat multicellulair organisme triljoenen cellen?
- Wat zijn 3 mechanismen en aanpassingen voor zaadverspreiding?
- Wetenschappers gebruiken robots om te onthullen hoe roofvissen omgaan met onvoorspelbare prooien
- Onderzoekers analyseren prijsklassen van gevoerde runderen onderhandelde contante verkoop
- Waarom is het het beste voor wetenschapper om de naam van een organisme te gebruiken in plaats daarvan een gemeenschappelijke naam?
- Inheemse vissoorten lopen gevaar na verwijdering van water uit de Colorado-rivier
- Welk anion kritisch betrokken bij botvorming?
- Nieuw pathogeen mechanisme voor influenza NS1-eiwit gevonden

- Het onthullen van verborgen fasen van materie door de kracht van licht
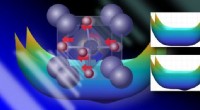
- Omzetting van CO2 naar CO op kamertemperatuur:een nieuwe manier om koolwaterstoffen te synthetiseren

- Duurzaam transport:de lucht zuiveren met stikstofdoping

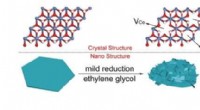
- Rijke defecten die de zuurstofontwikkelingsreactie stimuleren
 Een geïllustreerde geschiedenis van energie
Een geïllustreerde geschiedenis van energie  Moleculair detectieplatform biedt nieuwe inzichten in de productie van gengeneesmiddelen
Moleculair detectieplatform biedt nieuwe inzichten in de productie van gengeneesmiddelen Hoe werken olieveldpompen?
Hoe werken olieveldpompen?  Hoeveel allelen heeft een gameet van een erwtenplant voor het lengtegen?
Hoeveel allelen heeft een gameet van een erwtenplant voor het lengtegen?  Wat is waar of niet waar, een verbinding heeft dezelfde eigenschappen als de elementen waaruit deze is gevormd?
Wat is waar of niet waar, een verbinding heeft dezelfde eigenschappen als de elementen waaruit deze is gevormd?  Hoe kunt u energie krijgen van een waterwiel?
Hoe kunt u energie krijgen van een waterwiel?  Hoe werd de zon gevormd zodat hij warmte en licht kan afgeven?
Hoe werd de zon gevormd zodat hij warmte en licht kan afgeven?  De aanwezigheid hiervan in water veroorzaakt elektriciteit.
De aanwezigheid hiervan in water veroorzaakt elektriciteit.
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

