
Wetenschap
Wordt een verandering in kleur waargenomen wanneer koper II sulfaatkristallen worden uitgedroogd, hoe wordt u verklaard dat het water wordt toegevoegd aan verwarmd sulfaat?
De kleurverandering
* gehydrateerd koper (ii) sulfaat: Wanneer koper (II) sulfaat gehydrateerd is (wat betekent dat het watermoleculen heeft opgenomen in zijn kristalstructuur), heeft het een prachtige blauwe kleur. Dit komt omdat de watermoleculen worden gecoördineerd met de koper (II) ionen, waardoor een specifieke opstelling van elektronen wordt veroorzaakt die bepaalde lichtlengten absorberen, wat resulteert in de blauwe kleur.
* Dehydrated koper (II) sulfaat: Wanneer verwarmd, worden de watermoleculen afgedreven, waardoor het watervrij koper (II) sulfaat achterblijft. Deze vorm is een licht wit of grijsachtig wit. Het verlies van water verstoort de opstelling van elektronen rond de koper (II) ionen, wat leidt tot een verandering in de manier waarop het met licht interageert, waardoor de kleur wordt gewijzigd.
Water terug toevoegen
* rehydratatie: Als u water toevoegt aan het gedehydrateerde koper (II) sulfaat, zal het het water gemakkelijk terug in zijn kristalstructuur absorberen. Dit proces staat bekend als rehydratatie. Naarmate de watermoleculen terugkeren, wordt de coördinatie rond de koper (II) -ionen hersteld en verschijnt de blauwe kleur opnieuw.
Samenvattend:
* gehydrateerd koper (II) sulfaat (CUSO₄ • 5H₂O): Blauwe kleur als gevolg van water gecoördineerd met koperionen.
* Dehydrated koper (II) sulfaat (CUSO₄): Wit of grijsachtig wit vanwege de afwezigheid van watermoleculen.
Deze kleurverandering is een visuele demonstratie van hoe water het uiterlijk en de chemische eigenschappen van een stof dramatisch kan beïnvloeden.
 Beukenbomen die inheems zijn in Schotland, wetenschappers ontdekken
Beukenbomen die inheems zijn in Schotland, wetenschappers ontdekken Bescherming tegen overstromingen is ieders verantwoordelijkheid
Bescherming tegen overstromingen is ieders verantwoordelijkheid Wat is het klimaathoofd?
Wat is het klimaathoofd?  Er is maar één manier om bosbranden minder krachtig te maken:verwijder het spul dat brandt
Er is maar één manier om bosbranden minder krachtig te maken:verwijder het spul dat brandt Wat betekent bijbelse toepassing in een Science Fair -project?
Wat betekent bijbelse toepassing in een Science Fair -project?
Hoofdlijnen
- Hoe wordt de studie van afval genoemd?
- Onderzoekers identificeren genen die belangrijk zijn voor aanpassing en bepalen dat wortels een sleutel zijn tot droogtetolerante maïs
- Welke delen zijn zichtbaar in een kikkerbloedcel?
- Is de kern in plaveiselcellen centraal gelegen?
- Onderzoek onderzoekt waarom werknemers vals spelen en hoe bedrijven onbewust aan dit gedrag kunnen bijdragen
- Kan alle micro -organisme worden gekweekt met behulp van synthetische media?
- Wat testen wetenschappers?
- Bevat RNA een genetische code?
- Membraaneiwitten van bacteriën en mensen vertonen verrassende overeenkomsten
- 3D-geprinte potten in experimenten met kogelfrezen

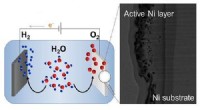
- Water splitsen voor de prijs van een nikkel
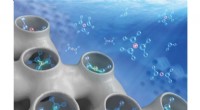
- Onthulling hoe water en ionen chemische reactiviteiten beïnvloeden op vast-waterige interfaces
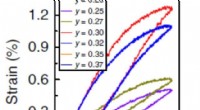
- Nieuw keramisch materiaal kan de kosten van piëzo-elektrische apparaten verlagen
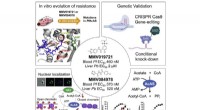
- Biologische ingenieurs vinden een nieuw doelwit voor malariamedicijnen
 Hoe cellen zichzelf beschermen tegen mitochondriale defecten
Hoe cellen zichzelf beschermen tegen mitochondriale defecten  Indiaas team trekt op zoek naar vermiste klimmers op Himalaya-helling
Indiaas team trekt op zoek naar vermiste klimmers op Himalaya-helling Hoe vierkante voet te berekenen
Hoe vierkante voet te berekenen Welke twee platen zijn verantwoordelijk voor het ontstaan van het Himalayagebergte?
Welke twee platen zijn verantwoordelijk voor het ontstaan van het Himalayagebergte?  Wanneer is seismometer gecreëerd?
Wanneer is seismometer gecreëerd?  Waarom Godzilla het perfecte monster is voor onze tijd van vernietiging van het milieu
Waarom Godzilla het perfecte monster is voor onze tijd van vernietiging van het milieu De krimpende eland van Isle Royale
De krimpende eland van Isle Royale Wat is een niet-voorbeeld van geotropisme?
Wat is een niet-voorbeeld van geotropisme?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

