
Wetenschap
Waarom is zuurstof elektronegatiefer dan zwavel?
* kleinere atoommaat: Zuurstof heeft een kleinere atoomradius dan zwavel. Dit betekent dat de elektronen in de buitenste schaal van zuurstof dichter bij de kern liggen en een sterkere aantrekkingskracht ervaren.
* Hogere effectieve nucleaire lading: De effectieve nucleaire lading (de netto positieve lading ervaren door een elektron) is groter voor zuurstof dan voor zwavel. Dit komt omdat zuurstof een hogere nucleaire lading (meer protonen) heeft en minder binnenste elektronen die de buitenste elektronen beschermen.
* Hogere elektronenaffiniteit: Zuurstof heeft een hogere elektronenaffiniteit dan zwavel, wat betekent dat het meer energie vrijgeeft wanneer het een elektron krijgt. Dit duidt op een sterkere aantrekkingskracht voor elektronen.
Samenvattend: De kleinere omvang, de grotere effectieve nucleaire lading en hogere elektronenaffiniteit van zuurstof dragen allemaal bij aan de grotere elektronegativiteit in vergelijking met zwavel.
 Wat is de atoommassa van ijzer?
Wat is de atoommassa van ijzer?  Waarom is fenoxide -ion reactiever dan fenol naar elektrofiele subsitititiekrachtreactie?
Waarom is fenoxide -ion reactiever dan fenol naar elektrofiele subsitititiekrachtreactie?  Hoeveel atomen zijn er in een steen?
Hoeveel atomen zijn er in een steen?  Wetenschappers vereenvoudigen het proces om polymeren te maken met door licht geactiveerde nanodeeltjes
Wetenschappers vereenvoudigen het proces om polymeren te maken met door licht geactiveerde nanodeeltjes Koel bewaren:een veelgebruikt koelmiddel is veelbelovend voor metaalrecycling
Koel bewaren:een veelgebruikt koelmiddel is veelbelovend voor metaalrecycling
 Hoe kleur bepaalt welke dieren we vrezen – en beschermen
Hoe kleur bepaalt welke dieren we vrezen – en beschermen  Een object in vrije val doet wat tot het de grond bereikt?
Een object in vrije val doet wat tot het de grond bereikt?  Onderzoekers onthullen veranderingen in het water van het Canadese noordpoolgebied
Onderzoekers onthullen veranderingen in het water van het Canadese noordpoolgebied Een evenwicht vinden tussen klimaatactie en sociale gelijkheid
Een evenwicht vinden tussen klimaatactie en sociale gelijkheid Een duidelijker beeld van de wereldwijde ijskapmassa
Een duidelijker beeld van de wereldwijde ijskapmassa
Hoofdlijnen
- Nieuw onderzoek vraagt zich af waarom sommige automobilisten agressiever zijn tegenover fietsers
- Wat zijn borstcellen?
- Naam van planten die groeien zonder zaden?
- De IQ-schaal:wat betekent uw IQ-score echt?
- Wat is een evolutionaire boom, hoe anders dan een stamboom?
- Biologische experimenten op de gisting van gist
- Hoe werken organismen nuttige en schadelijke manieren op?
- Cytoplasma dat de kern van een neuron omringt?
- Welk deel van ons lichaam dient als een lever soort eenvoudige machine?
- Ladingsverandering:hoe elektrische krachten variëren in colloïden

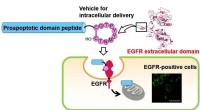
- Ontdekking van een nieuw voertuigpeptide opent een route voor medicijnafgifte
- Noch glad noch ruw:nieuwe bio-geïnspireerde oppervlakken laten insecten wegglijden

- Onderzoekers volgen eiwitbinding, bouwen synthetische eiwitten om genexpressie te bestuderen

- Wat veroorzaakt het verval van oplaadbare batterijen? Hangt ervan af hoe vaak je het hebt opgeladen

 Hogesnelheidsnetwerk voor eerstehulpverleners baart zorgen
Hogesnelheidsnetwerk voor eerstehulpverleners baart zorgen Efficiëntere risicobeoordeling voor nanomaterialen
Efficiëntere risicobeoordeling voor nanomaterialen In een diepe mijngeoloog ontdekte geoloog de band van stollingsrots die door wat kalkstenen bedwhat Kind Rocks snijden, was die band?
In een diepe mijngeoloog ontdekte geoloog de band van stollingsrots die door wat kalkstenen bedwhat Kind Rocks snijden, was die band?  Wil je de toeristische hordes van Europa vermijden? Probeer buiten de gebaande paden te treden
Wil je de toeristische hordes van Europa vermijden? Probeer buiten de gebaande paden te treden  Oud DNA onthult kinderen met het syndroom van Down in vroegere samenlevingen. Wat kunnen hun begrafenissen ons vertellen over levens?
Oud DNA onthult kinderen met het syndroom van Down in vroegere samenlevingen. Wat kunnen hun begrafenissen ons vertellen over levens?  Wat heeft een pH-waarde van 3?
Wat heeft een pH-waarde van 3?  Verrassend ionisch en stromingsgedrag met gefunctionaliseerde nanokanalen
Verrassend ionisch en stromingsgedrag met gefunctionaliseerde nanokanalen Welke wetenschapper stond het best bekend om het uitleggen van de zwaartekracht?
Welke wetenschapper stond het best bekend om het uitleggen van de zwaartekracht?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

