
Wetenschap
Waarom is waterstofbinding niet aanwezig in sulfide?
Dit is waarom:
* Vereisten voor waterstofbinding: Waterstofbinding treedt op wanneer een waterstofatoom wordt gebonden aan een sterk elektronegatief atoom zoals zuurstof (O), fluor (F) of stikstof (N). Dit creëert een sterk dipoolmoment, waarbij het waterstofatoom een gedeeltelijke positieve lading heeft en het elektronegatieve atoom een gedeeltelijke negatieve lading heeft.
* Sulphur's Electronegativity: Zwavel is minder elektronegatief dan zuurstof, fluor of stikstof. Dit betekent dat de S-H-binding minder polair is, en het waterstofatoom heeft geen sterk genoeg positieve lading om deel te nemen aan waterstofbinding.
* Zwakke interacties: Hoewel er misschien enkele zwakke interacties zijn tussen S-H-groepen als gevolg van van der Waals-krachten, worden deze niet beschouwd als echte waterstofbruggen.
Samenvattend, Het ontbreken van sterke dipoolmomenten in S-H-bindingen voorkomt de vorming van waterstofbruggen in sulfiden.
 Waaruit bestaat koolstofallotroop?
Waaruit bestaat koolstofallotroop?  Hoe gehoorzaamt zuurstof de Octect -regel bij het reageren om verbindingen te vormen?
Hoe gehoorzaamt zuurstof de Octect -regel bij het reageren om verbindingen te vormen?  Hoeveel neutronen zitten er in een isotoop van chloor 36?
Hoeveel neutronen zitten er in een isotoop van chloor 36?  Wat is de studie van perslucht?
Wat is de studie van perslucht?  DNA-schade begrijpen:modelleren hoe schade aan elektronen met lage energie de bestralingstherapie kan verbeteren
DNA-schade begrijpen:modelleren hoe schade aan elektronen met lage energie de bestralingstherapie kan verbeteren
 Dodental orkanen in Puerto Rico op bijna 3 000
Dodental orkanen in Puerto Rico op bijna 3 000 Zonne-geo-engineering kan effectief zijn bij het verlichten van de effecten van de opwarming van de aarde op gewassen
Zonne-geo-engineering kan effectief zijn bij het verlichten van de effecten van de opwarming van de aarde op gewassen Studie suggereert dat de winters in La Niña kunnen blijven komen
Studie suggereert dat de winters in La Niña kunnen blijven komen Wat zijn twee belangrijke milieu -uitdagingen waarmee de samenleving wordt geconfronteerd?
Wat zijn twee belangrijke milieu -uitdagingen waarmee de samenleving wordt geconfronteerd?  Welke objecten worden tot elkaar aangetrokken?
Welke objecten worden tot elkaar aangetrokken?
Hoofdlijnen
- Onderzoek onderzoekt hoe beslissingen over embryonale ontwikkeling tegelijkertijd via meerdere routes worden bestuurd
- Waarom zouden defecte recessieve allelen in de genenpool worden bewaard?
- Wat betekent inductie in de wetenschap?
- Hoe is Euglena vergelijkbaar met een plantencel?
- Waarom heeft een menselijke spiercel meer dan mitochondria -plantencel?
- Het geheime leven van planten onthuld:ontdekking heeft gevolgen voor voedselproductie en koolstofopslag
- Hoe wordt de studie van wormen genoemd?
- Gliale cellen (Glia): definitie, functie, typen
- Hoe voert een plant fotosynthese uit?
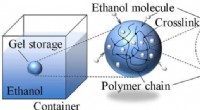
- Wetenschappers laten zien hoe vloeibare brandstoffen in polymere gels kunnen worden opgeslagen om explosies en branden te voorkomen
- Smart label kan je op een dag laten weten wanneer je voedsel en cosmetica moet weggooien

- Wetenschappers maken plastic van suiker en koolstofdioxide

- Moleculaire poriën kunnen de efficiëntie van olieraffinage en farmaceutische productie verbeteren

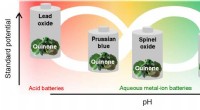
- Goedkoop organisch materiaal geeft veilige batterijen een langere levensduur
 Kruist kernenergie een grote hoeveelheid afval?
Kruist kernenergie een grote hoeveelheid afval?  Hawaï droogte tijdens El Niño winter? Niet altijd, volgens nieuw onderzoek
Hawaï droogte tijdens El Niño winter? Niet altijd, volgens nieuw onderzoek Vuursteenvlokgereedschap gedeeltelijk bedekt met berkenteer draagt bij aan het bewijs van het complexe denken van de Neanderthaler
Vuursteenvlokgereedschap gedeeltelijk bedekt met berkenteer draagt bij aan het bewijs van het complexe denken van de Neanderthaler Helpen hervormingen van de campagnefinanciering werkelijk om de verkiezingen competitiever te maken?
Helpen hervormingen van de campagnefinanciering werkelijk om de verkiezingen competitiever te maken?  Schelpen en grapefruits inspireren het eerste vervaardigde niet-snijbare materiaal
Schelpen en grapefruits inspireren het eerste vervaardigde niet-snijbare materiaal Simuleren van elektronische nanocomponenten voor het ontwikkelings- en productieproces
Simuleren van elektronische nanocomponenten voor het ontwikkelings- en productieproces Kaarten markeren steden in Michigan, groepen die het zwaarst zullen lijden onder de gevolgen van klimaatverandering
Kaarten markeren steden in Michigan, groepen die het zwaarst zullen lijden onder de gevolgen van klimaatverandering Waarom de Chinese e-commercegigant Alibaba struikelde over zijn Amerikaanse winkelsite
Waarom de Chinese e-commercegigant Alibaba struikelde over zijn Amerikaanse winkelsite
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

