
Wetenschap
Hoeveel lading in een zwavelion?
Hier leest u hoe u de lading van een zwavelion kunt bepalen:
* Sulphur's positie op het periodiek systeem: Zwavel (s) bevindt zich in groep 16 (ook wel via het periodiek systeem genoemd. Elementen in deze groep hebben de neiging om twee elektronen te krijgen om een stabiel octet (8 elektronen) in hun buitenste schaal te bereiken.
* ionische lading: Om deze twee elektronen te winnen, wordt zwavel een negatief geladen ion. De lading wordt weergegeven als een superscript na het elementsymbool.
* zwavelion: Daarom is de lading van een zwavelion 2- , geschreven als s²⁻ .
 44 Geef de empirische formule die overeenkomt met elk van de volgende moleculaire formules A natriumperoxide Na2O2 B Tereeftaalzuur C8H6O4 C Fenobarbital C12H12N2O3 D 1?
44 Geef de empirische formule die overeenkomt met elk van de volgende moleculaire formules A natriumperoxide Na2O2 B Tereeftaalzuur C8H6O4 C Fenobarbital C12H12N2O3 D 1?  Wat is het verschil tussen fysische en chemische verweringsverandering?
Wat is het verschil tussen fysische en chemische verweringsverandering?  Hoe verschillen de veranderingen die optreden wanneer water wordt gemengd met zout van resultaat natrium?
Hoe verschillen de veranderingen die optreden wanneer water wordt gemengd met zout van resultaat natrium?  Thermische dynamica experimenten voor kinderen
Thermische dynamica experimenten voor kinderen  Welke van de volgende elementen zou meer reactief zijn met andere boor?
Welke van de volgende elementen zou meer reactief zijn met andere boor?
Hoofdlijnen
- UFO-psychologie
- Wat gebeurt er na mitose om twee dochtercellen te produceren?
- Waarom wordt DNA getranscribeerd?
- Wat betekent het woordklasse in een wetenschappelijke term?
- Wat microben ons kunnen vertellen over het leven op aarde en in de ruimte
- Hoe ontrouw neven en nichten helpt:mannen delen mogelijk meer genen met de kinderen van zussen dan met vreemdgaande echtgenotes
- Wil je een bluebottle-steek vermijden? Zo kun je voorspellen op welk strand ze zullen landen
- Zonder goed beheer raakt de Braziliaanse Cerrado misvormd en minder veerkrachtig tegen de klimaatverandering
- Wat zijn de vier steriele sites in het menselijk lichaam?
- Nieuwe reactie maakt indoline-steigers beschikbaar voor farmaceutische ontwikkeling

- Elektrisch verwarmd textiel nu mogelijk
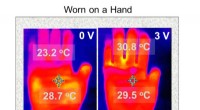
- Een technologie om 2D-vlakken om te zetten in zachte en flexibele 3D-structuren door hechting tussen dunne films te ontwikkelen

- Wetenschappers analyseren structuur, mechanisme van faageiwit dat elektronen steelt

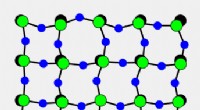
- Het geheim achter kristallen die krimpen bij verhitting
 Facebook-vacatureservice verspreidt zich naar meer landen
Facebook-vacatureservice verspreidt zich naar meer landen De VS doen een grote aanbetaling voor klimaatverandering. Dit is wat er moet komen
De VS doen een grote aanbetaling voor klimaatverandering. Dit is wat er moet komen Cultuurclashshows in rockhelter grafitti
Cultuurclashshows in rockhelter grafitti Wat is het enige verschil tussen biomassa -energie en windenergie?
Wat is het enige verschil tussen biomassa -energie en windenergie?  Wat is het geografische raster?
Wat is het geografische raster?  Waar komt de centrale vruchtbare grond vandaan?
Waar komt de centrale vruchtbare grond vandaan?  Onthullend complex gedrag van een turbulente pluim aan het afkalffront van een Groenlandse gletsjer
Onthullend complex gedrag van een turbulente pluim aan het afkalffront van een Groenlandse gletsjer Wat doet zeep met de polariteit van een watermolecuul?
Wat doet zeep met de polariteit van een watermolecuul?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

