
Wetenschap
Waarom ontwikkelt zich een dipool in molecuul?
1. Polaire covalente bindingen:
* elektronegativiteit: Wanneer twee atomen met verschillende elektronegativiteitswaarden een binding vormen, trekt het meer elektronegatief atoom de gedeelde elektronen sterker aan. Dit creëert een gedeeltelijke negatieve lading (Δ-) op het meer elektronegatieve atoom en een gedeeltelijke positieve lading (A+) op het minder elektronegatieve atoom.
* Voorbeeld: In een watermolecuul (H₂O) is zuurstof elektronegatiefer dan waterstof. Dit betekent dat het zuurstofatoom de gedeelde elektronen dichter bij zichzelf trekt, waardoor het zuurstofuiteinde van het molecuul enigszins negatief wordt en de waterstof enigszins positief.
2. Moleculaire geometrie:
* Asymmetrische vorm: Zelfs als de individuele bindingen in een molecuul niet -polair zijn (gelijk delen van elektronen), kan het molecuul nog steeds een dipoolmoment hebben als het molecuul een asymmetrische vorm heeft. Dit komt omdat de gedeeltelijke kosten van de afzonderlijke obligaties elkaar niet annuleren.
* Voorbeeld: Koolstofdioxide (CO₂) heeft twee polaire bindingen (C =O), maar het molecuul is lineair. De dipoolmomenten van de twee bindingen annuleren elkaar, waardoor het molecuul niet -polair is. Water heeft echter een gebogen vorm. De twee polaire bindingen annuleren elkaar niet uit, wat resulteert in een netto dipoolmoment voor het hele watermolecuul.
Samenvattend:
* Polaire covalente bindingen: Verschil in elektronegativiteit tussen atomen creëert gedeeltelijke ladingen.
* Asymmetrische vorm: Niet-cancellatie van individuele binddipolen als gevolg van ongelijke verdeling van elektronendichtheid.
Beide factoren dragen bij aan de ontwikkeling van een dipoolmoment binnen een molecuul. Dit dipoolmoment kan aanzienlijke effecten hebben op de eigenschappen van het molecuul, inclusief de oplosbaarheid, het kookpunt en de interactie met andere moleculen.
 De binnenwateren zien er uitnodigend uit als de hitte toeslaat. Hoe mensen veilig kunnen zwemmen op natuurlijke zwemplekken
De binnenwateren zien er uitnodigend uit als de hitte toeslaat. Hoe mensen veilig kunnen zwemmen op natuurlijke zwemplekken  Bomen die snel leven sterven jong
Bomen die snel leven sterven jong Waarom werd Darwins -theorie niet geaccepteerd?
Waarom werd Darwins -theorie niet geaccepteerd?  Wat zou er met een beschaving gebeuren als het klimaat verandert en rivieren opdrogen of natuurlijk?
Wat zou er met een beschaving gebeuren als het klimaat verandert en rivieren opdrogen of natuurlijk?  VN:Grote veranderingen in de samenleving nodig om de natuur te behouden, Aarde OK
VN:Grote veranderingen in de samenleving nodig om de natuur te behouden, Aarde OK
Hoofdlijnen
- Wat zijn alle biomen in Alaska?
- Drie decennia van onderzoek mondt uit in meer unieke orchideeënsoorten
- Wat is de betekenis van wetenschappelijke woordniche?
- Cellen uit de vroege aarde zijn gemodelleerd om te laten zien hoe eerste levensvormen RNA zouden kunnen hebben verpakt
- Muggen gebruiken darmbacteriën om de malaria die ze overbrengen te bestrijden. Wetenschappers onderzoeken hoe dit komt
- Wat betekent controle van de wetenschappelijke methode?
- Hoeveel genomen van levende organismen zijn gesequenced geweest?
- Wat is de voedselketen van een bladdraak?
- De controlerende organel in een cel is de?
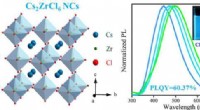
- Wetenschappers synthetiseren loodvrije op zirkonium gebaseerde vacature-geordende dubbele perovskiet nanokristallen
- Chemici ontwikkelen nieuwe methode om eiwitten te identificeren

- Atomaire resolutie-eiwitmodellen onthullen nieuwe details over eiwitbinding
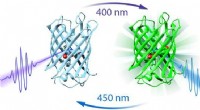
- Nieuwe techniek die laat zien hoe een eiwitlichtschakelaar werkt, kan biologisch onderzoek verbeteren
- Plastic-etend enzym kan miljarden tonnen afval op de stortplaats elimineren

 Hoe ziet Pluto eruit in de ruimte?
Hoe ziet Pluto eruit in de ruimte?  250 kleuters worden elke dag geschorst of verwijderd:vijf vragen beantwoord
250 kleuters worden elke dag geschorst of verwijderd:vijf vragen beantwoord Volgens de wet van universele zwaartekracht is de zwaartekracht tussen twee objecten gerelateerd aan hun massa en wat anders?
Volgens de wet van universele zwaartekracht is de zwaartekracht tussen twee objecten gerelateerd aan hun massa en wat anders?  Wat zijn aanpassingen aan een grevillea?
Wat zijn aanpassingen aan een grevillea?  Hoeveel nucleaire bommen zou je moeten ontploffen, hoeveel energie de zon zet in één seconde?
Hoeveel nucleaire bommen zou je moeten ontploffen, hoeveel energie de zon zet in één seconde?  Wat is de staat van materie rots in asthenosfeer?
Wat is de staat van materie rots in asthenosfeer?  Hoe heeft S ontdekking dat het universum momenteel verandert op het gebied van de wetenschappelijke gedachte over de grootte van het verleden?
Hoe heeft S ontdekking dat het universum momenteel verandert op het gebied van de wetenschappelijke gedachte over de grootte van het verleden?  Welke structuurenzymen moeten worden afgebroken?
Welke structuurenzymen moeten worden afgebroken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

