
Wetenschap
Waarom is het molecuul stikstof pentachloride onmogelijk?
* de beperkte valentie van stikstof: Stikstof heeft slechts vijf valentie -elektronen, wat betekent dat het maximaal vijf bindingen kan vormen. In NCL 5 , stikstof zou vijf bindingen met chloor moeten vormen, die zijn valentie overschrijden.
* sterische hindering: Zelfs als stikstof vijf bindingen zou kunnen vormen, zou de grootte van vijf chlooratomen rond een stikstofatoom significante sterische hindering veroorzaken, waardoor het molecuul onstabiel en zeer reactief wordt.
* Elektronische configuratie: Stikstof elektronische configuratie (2S
2
2p
3
) Hiermee kan het maximaal drie covalente bindingen vormen. Hoewel het zijn octet in sommige gevallen kan uitbreiden, is het beperkt tot maximaal vier obligaties, niet vijf.
Daarom is de vorming van ncl 5 is niet mogelijk vanwege de beperkingen van stikstof in termen van valentie, sterische hinder en elektronische configuratie.
 Gespannen, symmetrisch, en nieuw:tetravinylalleen, een klein maar krachtig molecuul, is voor het eerst gesynthetiseerd
Gespannen, symmetrisch, en nieuw:tetravinylalleen, een klein maar krachtig molecuul, is voor het eerst gesynthetiseerd Elektronenstipdiagram voor zwavel 8 molecuul?
Elektronenstipdiagram voor zwavel 8 molecuul?  Hoe bepalen wetenschappers de atomaire massa van een atoom?
Hoe bepalen wetenschappers de atomaire massa van een atoom?  Waarom wordt octanol gebruikt om de partitiecoëfficiënt te bepalen?
Waarom wordt octanol gebruikt om de partitiecoëfficiënt te bepalen?  Wat zijn de twee redenen waarom koolstofverbindingen zo belangrijk zijn?
Wat zijn de twee redenen waarom koolstofverbindingen zo belangrijk zijn?
 Wat zijn de dingen die op aarde aanwezig zijn?
Wat zijn de dingen die op aarde aanwezig zijn?  Hoe zeeslakken verliefd worden
Hoe zeeslakken verliefd worden  Uit onderzoek naar de klimaatschadelijke palmolieproductie in Indonesië blijkt dat er sprake is van een drang naar industrialisatie
Uit onderzoek naar de klimaatschadelijke palmolieproductie in Indonesië blijkt dat er sprake is van een drang naar industrialisatie  Werken tussen de pinguïns? Frankrijk zoekt kandidaten
Werken tussen de pinguïns? Frankrijk zoekt kandidaten Duitsland registreert heetste jaar in een eeuw
Duitsland registreert heetste jaar in een eeuw
Hoofdlijnen
- Wat is Dinobacteria?
- Onderzoekers stemmen af op eiwitparen:team kwantificeert hoe mutaties celsignalerende bacteriën beïnvloeden
- Zijn twee fasen van quarantaine beter dan één?
- Vriend en vijand? Hoe krabben voorkomen dat ze worden opgegeten
- Zou er een probleem zijn als het RNA -polymerase een verkeerde streng DNA -streng zou transcriberen en cel probeerde te maken?
- Een technische verhoging van de mesofylgeleiding verbetert de fotosynthese-efficiëntie in veldproeven
- Wat betekent een kern in de wetenschap?
- Onderzoekers zijn van mening dat de roofvogelcaracara een PR-make-over verdient
- Een beetje stress is goed voor de gezondheid van de cellen en een lang leven
- Wetenschappers onderzoeken hoe verschillende vloeibare organellen in cellen worden gemaakt
- Zelfherstellend cement kan de geothermische industrie transformeren

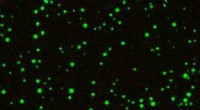
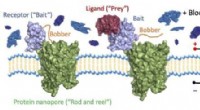
- Wetenschappers ontwikkelen moleculaire visserij om individuele moleculen in bloed te vinden
- Slechts een klein stukje papier kan het waterverbruik veiliger maken

- Onderzoekers karakteriseren moleculaire scharen voor plastic afval
 Steensoort gebruikt om monumenten te maken
Steensoort gebruikt om monumenten te maken Hoe heeft Albert Einstein TV ontdekt?
Hoe heeft Albert Einstein TV ontdekt?  Waarom nemen orbitale perioden toe naarmate de afstand tot de zon toeneemt?
Waarom nemen orbitale perioden toe naarmate de afstand tot de zon toeneemt?  Cilindrische klankkristallen voelen fysiek, chemische eigenschappen van getransporteerde vloeistoffen
Cilindrische klankkristallen voelen fysiek, chemische eigenschappen van getransporteerde vloeistoffen Hoe komt het dat astronomen liever de sterren van grote hoogten observeren?
Hoe komt het dat astronomen liever de sterren van grote hoogten observeren?  Geluidsgeïnduceerde elektrische velden beheersen de kleinste deeltjes
Geluidsgeïnduceerde elektrische velden beheersen de kleinste deeltjes Wat voor soort energie wordt gegenereerd door de zon?
Wat voor soort energie wordt gegenereerd door de zon?  Welke energie is een voorbeeld van kinetische energie?
Welke energie is een voorbeeld van kinetische energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

