
Wetenschap
Zou een zwavel positief ion worden voordat hij zich bindt?
Dit is waarom:
* elektronegativiteit: Zwavel heeft een relatief hoge elektronegativiteit (2,58 op de Pauling -schaal). Dit betekent dat het een sterke neiging heeft om elektronen naar zichzelf aan te trekken.
* ionisatie -energie: Zwavel heeft een relatief hoge ionisatie -energie, wat betekent dat het een aanzienlijke hoeveelheid energie vereist om een elektron te verwijderen en een positief ion (kation) te vormen.
Daarom is zwavel eerder winst elektronen om een stabiel octet te bereiken en een negatief ion (anion) te worden bij het binden.
Er zijn echter enkele uitzonderingen:
* met zeer elektronegatieve elementen: Zwavel kan positieve ionen vormen wanneer ze worden gebonden aan elementen met veel hogere elektronegativiteit, zoals zuurstof (in verbindingen zoals SO₂ of zo₃).
* In specifieke reacties: Onder bepaalde omstandigheden kan zwavel elektronen verliezen om een positief ion te vormen, maar deze komen minder vaak voor dan de neiging om elektronen te winnen.
Over het algemeen zal zwavel eerder fungeren als een anion In de meeste bindingsscenario's vanwege de elektronegativiteits- en ionisatie -energie.
 Wat zijn de kenmerken van subtances en mengsels?
Wat zijn de kenmerken van subtances en mengsels?  Is chloor meer elektronegatief dan zwavel?
Is chloor meer elektronegatief dan zwavel?  Wat is de structuur van bindingen in tetrodotoxine?
Wat is de structuur van bindingen in tetrodotoxine?  Wat gebeurt er als aluminium reageert met ijzeroxide in een enkele verplaatsingsreactie?
Wat gebeurt er als aluminium reageert met ijzeroxide in een enkele verplaatsingsreactie?  Studie benadrukt belofte van galliumoxiden voor stralingsdetectoren van de volgende generatie
Studie benadrukt belofte van galliumoxiden voor stralingsdetectoren van de volgende generatie
 Hoe heet een boom botanicus?
Hoe heet een boom botanicus?  Op welke twee dingen tussen objecten zijn de zwaartekracht afhankelijk van de zwaartekracht?
Op welke twee dingen tussen objecten zijn de zwaartekracht afhankelijk van de zwaartekracht?  Chemische verwering kan sommige effecten van klimaatverandering verlichten
Chemische verwering kan sommige effecten van klimaatverandering verlichten Duizenden grote energievertegenwoordigers bij VN-klimaatbesprekingen:monitor
Duizenden grote energievertegenwoordigers bij VN-klimaatbesprekingen:monitor Afbeelding:Boliviaanse ontbossing
Afbeelding:Boliviaanse ontbossing
Hoofdlijnen
- Monster ontdekt in het Canadese Noordpoolgebied
- Heerlijke narcissen zijn super eenvoudig te kweken. Hier is hoe
- Wat is een wetenschapper die een reeks test uitvoert, is in elk opzicht identiek voor één factor die de gemanipuleerde variabe?
- Naar welk lid van een paar of seri -genen die een specifieke positie innemen op chromosoom wordt verwezen?
- Reproductieproces bij mensen
- Wat bevat een erfelijke informatie.
- Wat zijn enkele redenen waarom apen gerelateerd aan de wetenschap?
- Beschrijf hoe eukaryotische cellen chromosomen veranderen als een cel zich voorbereidt op het delen van wat is het voordelig pakket -DNA voor deling?
- Beluga-walvissen veranderen wat ze eten als gevolg van klimaatverandering, studie vondsten
- Een olievlek opruimen

- Russische popmoleculen kunnen echt opruimen
- Gemethyleerde fenylarsenische metabolieten geïdentificeerd in kippenlevers
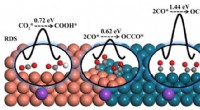
- Afstemming van reactiebarrières voor elektroreductie van kooldioxide tot producten met meerdere koolstofatomen
- Elementair boor is een effectieve fotothermokatalysator voor de omzetting van kooldioxide
 Welke kracht is nodig om een fiets van 80 kg te versnellen met een snelheid 1,85 ms2?
Welke kracht is nodig om een fiets van 80 kg te versnellen met een snelheid 1,85 ms2?  Wetenschappers vangen röntgenstralen op van opwaartse positieve bliksem
Wetenschappers vangen röntgenstralen op van opwaartse positieve bliksem  NASA-sonde Osiris-Rex gaat asteroïde Bennu kussen tijdens historische missie
NASA-sonde Osiris-Rex gaat asteroïde Bennu kussen tijdens historische missie Hoe wetenschappelijke experimenten met zout uit te voeren
Hoe wetenschappelijke experimenten met zout uit te voeren  Kubieke meters converteren naar Ton
Kubieke meters converteren naar Ton  Hoe kun je bewijzen of de aarde echt roteert?
Hoe kun je bewijzen of de aarde echt roteert?  Wat is het tegenovergestelde woord voor energiek?
Wat is het tegenovergestelde woord voor energiek?  Hoe snel werkt een paard?
Hoe snel werkt een paard?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

