
Wetenschap
Waarom is dihydrogen monosulfide polair?
Dihydrogen monosulfide (H₂s) is niet polair. Dit is waarom:
* Moleculaire geometrie: H₂s heeft een gebogen moleculaire geometrie, vergelijkbaar met water (H₂o). Dit komt door de twee eenzame paren elektronen op het zwavelatoom.
* elektronegativiteit: Zwavel is elektronegatiefer dan waterstof. Dit betekent dat zwavel de gedeelde elektronen in de H-S-bindingen sterker aantrekt.
* annulering van dipoolmomenten: Hoewel elke H-S-binding een licht dipoolmoment heeft, betekent de gebogen geometrie dat deze dipolen elkaar annuleren. Het molecuul als geheel heeft een nul netto dipoolmoment .
Daarom is dihydrogen monosulfide (H₂s) een niet -polair molecuul.
Hoofdlijnen
- Waar zijn hormonen een voorbeeld van?
- Wat is de naam Worm die papier eet?
- 1. Er is waarneembare verandering van elk soort organisme in een ander waar of onwaar?
- Wat doen wetenschappers na een onderzoek?
- Wat bepaalt de verschillende waterbiomen?
- Wat zijn Prions?
- Welk proces is de basis voor Food Web?
- Is genialiteit genetisch?
- Wat is de relatie tussen eiwitten en DNA?
- Doorbraak in synthese van scheikundigen bevordert een krachtig middel tegen kanker

- Een nieuwe manier om mannelijke vruchtbaarheid te beoordelen
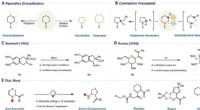
- Een reactie die zwavel verwijdert, stikstof- of zuurstofatomen uit zesledige ringen die alleen blauw licht gebruiken
- Zeer elastische biologisch afbreekbare hydrogel voor bioprinten van nieuwe weefsels

- Een mijlpaal in ultrasnelle gelfabricage van onconventionele zelfherstellende edelmetaalgels

 Wat voor soort wetenschapper bestudeert rots en stenen?
Wat voor soort wetenschapper bestudeert rots en stenen?  Een nieuw type superresolutie voor het onderzoeken van celdeling
Een nieuw type superresolutie voor het onderzoeken van celdeling  Is zwavelzuur zuurder dan citroensap?
Is zwavelzuur zuurder dan citroensap?  Door studenten gebouwde satelliet wil inzicht geven in effecten van zonnestormen
Door studenten gebouwde satelliet wil inzicht geven in effecten van zonnestormen Het verschil tussen Pharaoh Quail Vs. Bobwhite Quail
Het verschil tussen Pharaoh Quail Vs. Bobwhite Quail  Welk effect hebben temperatuur en pH op enzymgestuurde reacties?
Welk effect hebben temperatuur en pH op enzymgestuurde reacties?  Welk type zonne -bekendheid is het heetst en verlengt de grootste afstand?
Welk type zonne -bekendheid is het heetst en verlengt de grootste afstand?  Ethisch dilemma? Vrouwen in de PR zijn meer geneigd om bondgenoten te zoeken voordat ze advies geven aan leidinggevenden
Ethisch dilemma? Vrouwen in de PR zijn meer geneigd om bondgenoten te zoeken voordat ze advies geven aan leidinggevenden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


