
Wetenschap
Waarom is koolstof minder reactief dan natrium?
1. Elektronenconfiguratie:
* natrium (NA): Heeft één valentie -elektron in zijn buitenste schaal. Dit elektron gaat gemakkelijk verloren, waardoor natrium zeer reactief en vatbaar is voor het vormen van kationen (+1 lading).
* koolstof (c): Heeft vier valentie -elektronen. Het kan vier elektronen krijgen om een volledig octet te bereiken (zoals in carbiden) of zijn elektronen delen met andere atomen om covalente bindingen te vormen. Dit maakt koolstof minder kans om gemakkelijk te verliezen of elektronen te krijgen.
2. Ionisatie -energie:
* natrium: Heeft een lage ionisatie -energie, wat betekent dat er minder energie voor nodig is om een elektron te verwijderen. Dit maakt het voor natrium gemakkelijker om een elektron te verliezen en een positief geladen ion te worden.
* koolstof: Heeft een hogere ionisatie -energie. Het vereist meer energie om een elektron uit de buitenste schaal te verwijderen. Dit maakt koolstof minder vatbaar voor het verliezen van elektronen.
3. Elektronegativiteit:
* natrium: Is een zeer elektropositief element (lage elektronegativiteit). Dit betekent dat het een sterke neiging heeft om elektronen te verliezen.
* koolstof: Heeft matige elektronegativiteit. Het is eerder geneigd elektronen te delen dan om ze volledig te verliezen.
4. Bindingskenmerken:
* natrium: Vormt ionische bindingen, waarbij het zijn elektron gemakkelijk overbrengt naar een ander atoom om een stabiele verbinding te vormen.
* koolstof: Vormt voornamelijk covalente obligaties, waar het elektronen deelt met andere atomen. Dit leidt tot sterkere en stabielere bindingen in vergelijking met ionische bindingen.
Samenvattend: De elektronenconfiguratie van koolstof, hogere ionisatie -energie, matige elektronegativiteit en sterke covalente binding maken het aanzienlijk minder reactief dan natrium, dat zijn enige valentie -elektron gemakkelijk verliest om ionische verbindingen te vormen.
 Wat is de samenstelling van de atmosferische lucht op zeeniveau?
Wat is de samenstelling van de atmosferische lucht op zeeniveau?  Wat is de moleculaire massa van jodium pentafluoride?
Wat is de moleculaire massa van jodium pentafluoride?  Afbreekbare elektronische componenten gemaakt van maïszetmeel
Afbreekbare elektronische componenten gemaakt van maïszetmeel Chemici vinden nieuwe manier om oude banden af te breken tot materiaal voor nieuwe
Chemici vinden nieuwe manier om oude banden af te breken tot materiaal voor nieuwe Wetenschappers ontsluiten het potentieel van ultradunne 2D-materialen
Wetenschappers ontsluiten het potentieel van ultradunne 2D-materialen
Hoofdlijnen
- Vindt fotosynthese plaats in een plant of dier?
- 5 verschillend tussen mitose en meiose hetzelfde geven me een lijst plz?
- Welk vet bevat grote hoeveelheden vetzuur die leidt tot een vermindering van de neiging van de neiging bloedstolsel?
- Wat is de functie van DNA in een chloroplast?
- Sprinten richting uitsterven? Het aantal cheetahs daalt wereldwijd
- Survival of the least-fit:antiviraal middel richt zich selectief op de meest onaangename virussen
- Waarom evolutie vaak de voorkeur geeft aan kleine dieren en andere organismen
- Wat kun je concluderen over een eiwit met een hoog molecuulgewicht dat niet naar de kern kan worden getransporteerd?
- Waarom groeit de wortel eerst?
- Samenwerking leidt tot nieuw model voor keramische geleidbaarheid

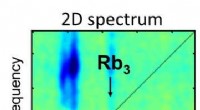
- Onderzoekers passen voor het eerst 2D-spectroscopie toe op geïsoleerde moleculaire systemen
- In legeringen met vormgeheugen, de juiste combinatie van kristalkorrels kan een hoge sterkte bereiken en toch geheugen behouden
- Onderzoekers testen cellen met siliciumanoden, aluminiumoxide coatings die kathoden beschermen

- Gefuseerde beeldvorming onthult zesde-eeuws schrift verborgen in boekbinden

 Wat is de formule voor jodiumgas?
Wat is de formule voor jodiumgas?  Onderzoeker stelt wereldwijd waarnemingssysteem voor zeespiegelstijging voor
Onderzoeker stelt wereldwijd waarnemingssysteem voor zeespiegelstijging voor Kenmerken van een pauwvogel
Kenmerken van een pauwvogel Informatieverwerking beperkt de manier waarop E. coli-bacteriën door chemische gradiënten navigeren
Informatieverwerking beperkt de manier waarop E. coli-bacteriën door chemische gradiënten navigeren  Wat zijn de drie soorten elektromagnetische golven die ioniseren dat betekent dat ze voldoende energie hebben, kan elektronen van atomen afslaan?
Wat zijn de drie soorten elektromagnetische golven die ioniseren dat betekent dat ze voldoende energie hebben, kan elektronen van atomen afslaan?  E-nose kan verschillende muntgeuren onderscheiden
E-nose kan verschillende muntgeuren onderscheiden Nieuwe nanodeeltjes helpen bij het opsporen van diepe weefselkanker
Nieuwe nanodeeltjes helpen bij het opsporen van diepe weefselkanker Wat is het doel van zout in DNA -extractie?
Wat is het doel van zout in DNA -extractie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

