
Wetenschap
Opladen op k in samengestelde kio4?
* Identificeer de bekende ladingen:
* Zuurstof (O) heeft meestal een -2 lading.
* Jodium (I) kan meerdere oxidatietoestanden hebben, maar in dit geval is het in de +7 oxidatietoestand om de ladingen van de vier zuurstofatomen in evenwicht te brengen.
* Bereken de algehele lading van het jodaation (IO4):
* Vier zuurstofatomen hebben een totale lading van -8 (4 x -2).
* Jodium heeft een +7 lading.
* Daarom heeft het jodium -ion (IO4) een algemene lading van -1 (+7 -8 =-1).
* Bepaal de lading van kalium (k):
* Aangezien KIO4 een neutrale verbinding is, moet de totale lading nul zijn.
* Om de -1 lading van het jodiumion in evenwicht te brengen, moet kalium (k) een +1 lading hebben.
Daarom is de lading op k in de samengestelde KIO4 +1.
 Hoeveel zwavelatomen zitten er in één gram zwavel?
Hoeveel zwavelatomen zitten er in één gram zwavel?  Welke is een groter arseenion of een broomionen?
Welke is een groter arseenion of een broomionen?  Veilig, efficiënte manier om waterstof te produceren uit aluminiumdeeltjes en water voor vliegtuigenergie tijdens de vlucht
Veilig, efficiënte manier om waterstof te produceren uit aluminiumdeeltjes en water voor vliegtuigenergie tijdens de vlucht Wat is het gebruik van de volgende elementen Lithium -koolstofzuurstof en fluor?
Wat is het gebruik van de volgende elementen Lithium -koolstofzuurstof en fluor?  Waarom zijn metaboorzuur en tetra-pyrozuren onstabiel in oplossing?
Waarom zijn metaboorzuur en tetra-pyrozuren onstabiel in oplossing?
 Waarom bestuderen wetenschappers Deuterium om de oorsprong van water op aarde te bepalen?
Waarom bestuderen wetenschappers Deuterium om de oorsprong van water op aarde te bepalen?  Geen vulkanische winter in Oost-Afrika door oude Toba-uitbarsting
Geen vulkanische winter in Oost-Afrika door oude Toba-uitbarsting Ambtenaren waarschuwen voor risico's van loodvervuiling na brand in Notre-Dame
Ambtenaren waarschuwen voor risico's van loodvervuiling na brand in Notre-Dame Zeemeeuwgedrag bij aardbevingen en veranderingen in het weer
Zeemeeuwgedrag bij aardbevingen en veranderingen in het weer  In wat zijn twee soorten omgeving waarin we geografie bestuderen?
In wat zijn twee soorten omgeving waarin we geografie bestuderen?
Hoofdlijnen
- In welk stadium van cellulaire ademhaling komen vetten -eiwitten en koolhydraten de metabolische route binnen?
- Wanneer worden twee populaties beschouwd als nieuwe en afzonderlijke soorten?
- Wat zijn de functies van mitochondria en chloroplasten hebben deze twee organellen gemeen met elkaar?
- Leg uit hoe het zenuwstelsel samenwerkt met andere systemen in het lichaam?
- Universiteiten houden van interdisciplinaire STEM-programma’s, maar hoe zit het met studenten?
- Wat doet ribosomen ermee overgebleven of afval?
- Habitat telt wanneer roofdieren op de loer liggen
- Hoe de squashlandbouw bijen verspreidde in het precolumbiaanse Noord-Amerika
- Verschillen tussen gisten en vormpjes
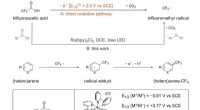
- Trifluorazijnzuur werkt als trifluormethyleringsmiddel bij de functionalisering van areen C-H
- Op de natuur geïnspireerde antibacteriële metalen

- Deze microben eten elektronen voor energie
- Chemici synthetiseren ultrasnelle cyanidedetector

- Wetenschappers ontsluiten het potentieel van ultradunne 2D-materialen

 Afbeelding:De galactische dans van NGC 5394 en NGC 5395
Afbeelding:De galactische dans van NGC 5394 en NGC 5395 Wat is een andere hoofdstad op dezelfde lengtegraad als Guyana?
Wat is een andere hoofdstad op dezelfde lengtegraad als Guyana?  Wat is de pka van chloroform?
Wat is de pka van chloroform?  Hoe klimaatverandering en geopolitieke instabiliteit kansen kunnen zijn om de gelijkheid in Nieuw-Zeeland te verbeteren
Hoe klimaatverandering en geopolitieke instabiliteit kansen kunnen zijn om de gelijkheid in Nieuw-Zeeland te verbeteren  Was Pluto de eerste dwergplaneet?
Was Pluto de eerste dwergplaneet?  Vouwen verschillende vloeistoffen uit met hoeveelheden voor dezelfde temperatuurstijging?
Vouwen verschillende vloeistoffen uit met hoeveelheden voor dezelfde temperatuurstijging?  Het inferno van binnenkomst overleven, afdaling en landing
Het inferno van binnenkomst overleven, afdaling en landing Wat waren de sondes die als eerste het oppervlak van de maan uitgebreid in kaart brachten?
Wat waren de sondes die als eerste het oppervlak van de maan uitgebreid in kaart brachten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

