
Wetenschap
Wat is de formule voor samengesteld jodiummonochloride?
Dit is waarom:
* jodium (i) :Jodium bevindt zich in groep 17 van het periodiek systeem, wat betekent dat het de neiging heeft om één elektron te krijgen om een anion te vormen met een -1 lading (I⁻).
* chloor (Cl) :Chloor is ook in groep 17 en heeft een vergelijkbare neiging om één elektron te krijgen om een anion te vormen met een -1 lading (CL⁻).
In deze verbinding is jodium echter meer elektronegatief dan chloor, wat betekent dat het een sterkere trek heeft op de gedeelde elektronen in de binding. Daarom fungeert jodium als het kation met een +1 lading (I⁺) en chloor fungeert als het anion met een -1 -lading (CL⁻).
Dit resulteert in de formule ICL, waarbij de kosten worden opgeheven.
 Wat zijn de twee primaire factoren die plaatsvinden in een moleculer -botsing?
Wat zijn de twee primaire factoren die plaatsvinden in een moleculer -botsing?  Hoe wordt het genoemd als Atom een positieve of negatieve lading heeft?
Hoe wordt het genoemd als Atom een positieve of negatieve lading heeft?  De reisroute van protonen in polymeren kan de weg wijzen naar schone brandstoffen
De reisroute van protonen in polymeren kan de weg wijzen naar schone brandstoffen Hoe lassen werkt
Hoe lassen werkt  Hebben warmer vloeistoffen min of meer viscositeit dan koudere vloeistoffen?
Hebben warmer vloeistoffen min of meer viscositeit dan koudere vloeistoffen?
Hoofdlijnen
- Spier nodig voor een lastige plek? Ga over op vette stamcellen
- Wat is de studie van hoe een interne structuur van een organismen functioneert?
- Welke groep organismen omvat alleen meercellige heterotrofen?
- Enzym dat gif Ivy giftig maakt?
- Wat is het proces door welk cellulair materiaal verdeeld tussen twee cellen?
- Onderzoek onder bijna een half miljoen voetbalfans laat zien hoe groepsidentiteit gedrag beïnvloedt
- Wat is een voorbeeld van een parasitaire schimmels?
- Wat is een voorbeeld van een parasiet in Afrika?
- Hoe vleermuizen virussen overbrengen zonder ziek te worden
- Nieuw model voor bimoleculaire reacties in nanoreactoren
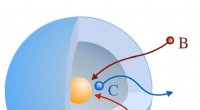
- Een fluorogene sonde kan de activiteit van multiresistente pathogenen in een testsysteem detecteren
- Team zorgt voor stabiliteit van ontziltingsproces met magnesium

- Een zeldzame prestatie:materiaal beschermt tegen zowel biologische als chemische bedreigingen
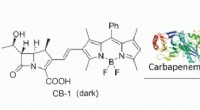
- Engineered C. glutamicum-stam die in staat is glutaarzuur op hoog niveau te produceren uit glucose
 Moderne zeespiegelstijging gekoppeld aan menselijke activiteiten, Rutgers-onderzoek bevestigt
Moderne zeespiegelstijging gekoppeld aan menselijke activiteiten, Rutgers-onderzoek bevestigt Hoe snel koelt extrusieve stollingsrotsen cool?
Hoe snel koelt extrusieve stollingsrotsen cool?  Waar vind je vooral dinosaurus fossiel?
Waar vind je vooral dinosaurus fossiel?  Aan welke twee delen van het aardsysteem is een paleontoloog betrokken?
Aan welke twee delen van het aardsysteem is een paleontoloog betrokken?  Voorspel de reactie tussen chloor en kalium astatide?
Voorspel de reactie tussen chloor en kalium astatide?  Hoe maak je diacetonalcohol uit ethanol?
Hoe maak je diacetonalcohol uit ethanol?  Hoeveel gids voor de Galaxy -films zijn er?
Hoeveel gids voor de Galaxy -films zijn er?  Wat is het aantal elektrische ladingprotonen?
Wat is het aantal elektrische ladingprotonen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

