
Wetenschap
Leg uit hoe chemici met zekerheid kunnen vermelden dat niemand een element tussen zwavel en chloor zal ontdekken?
Dit is waarom:
* Atomisch nummer: Het periodieke tabel is gerangschikt door het toenemende atoomnummer, dat het aantal protonen in de kern van een atoom vertegenwoordigt. Elk element heeft een uniek atoomnummer.
* Elektronenconfiguratie: Het periodiek systeem weerspiegelt ook de rangschikking van elektronen in atomen. De elementen zijn gegroepeerd op basis van hun elektronenconfiguraties, wat leidt tot voorspelbare chemische eigenschappen.
* Periodiciteit: Elementen in dezelfde verticale kolom (groep) hebben vergelijkbare chemische eigenschappen als gevolg van vergelijkbare buitenste elektronenconfiguraties. Dit staat bekend als periodiciteit.
zwavel (s) heeft een atoomnummer van 16 en chloor (CL) heeft een atoomnummer van 17. Dit betekent dat er geen mogelijke ruimte is voor een element met een atoomnummer tussen 16 en 17.
Met andere woorden, het atoomnummer is een continue volgorde en er is geen opening tussen zwavel en chloor voor een ander element om te bezetten.
Daarom is het ontdekken van een nieuw element tussen zwavel en chloor niet mogelijk binnen het gevestigde raamwerk van het periodiek systeem en ons begrip van de atomaire structuur.
 Hoeveel natriumchloride en andere zouten worden opgelost in een watermonster is de
Hoeveel natriumchloride en andere zouten worden opgelost in een watermonster is de  Kenmerken van fotosynthese
Kenmerken van fotosynthese  Temperatuurschaalconversie Een stuk droogijs vaste CO2 heeft temperatuur -100c Wat is het in Kelvins en graden F?
Temperatuurschaalconversie Een stuk droogijs vaste CO2 heeft temperatuur -100c Wat is het in Kelvins en graden F?  Welke liputure verandert een vaste vloeistof in vloeistof?
Welke liputure verandert een vaste vloeistof in vloeistof?  Besluipen op kleine kristallen met elektronendiffractie
Besluipen op kleine kristallen met elektronendiffractie
 Hoe koolstofverwijdering past in de architectuur van het EU-klimaatbeleid
Hoe koolstofverwijdering past in de architectuur van het EU-klimaatbeleid  Hoe kwik in de zee komt
Hoe kwik in de zee komt Bakstenen gemaakt van urine - onze plas is vloeibaar goud
Bakstenen gemaakt van urine - onze plas is vloeibaar goud  Hoe verklaart religie het bestaan van de aarde?
Hoe verklaart religie het bestaan van de aarde?  Orkanen kunnen tot vijf keer groter zijn in het Caribisch gebied als zwaardere doelen worden gemist
Orkanen kunnen tot vijf keer groter zijn in het Caribisch gebied als zwaardere doelen worden gemist
Hoofdlijnen
- Genetische ontdekking helpt Angus-producenten hun kuddes te beschermen
- Semantisch gesproken:verenigt betekenisstructuur talen?
- Florida probeert het tij te keren bij de invasie van leguaan
- Wat is allcalis?
- Wat beschrijft fenotypes het beste?
- Wat is de wetenschappelijke studie van optimaal menselijk functioneren?
- Hoe E. coli veilig door maagzuur gaat
- Hoe kunnen prokaryoten succesvoller zijn dan mensen?
- Bacteriën krijgen resistentie van concurrenten
- Een robot en software maken het eenvoudiger om geavanceerde materialen te maken

- Tellurium maakt het verschil

- Nieuwe immunoassaytechniek meet extreem lage concentraties van kleine moleculen met behulp van detectie van één molecuul
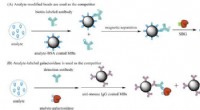
- Wetenschappers onthullen dubbele levensduur van zonnebloemenzym

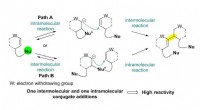
- Totale synthese van flueggenine C via een versnelde intermoleculaire Rauhut-Currier-reactie
 Hoe de latitude en longtitude in feet te zetten
Hoe de latitude en longtitude in feet te zetten Bodemontgifting op Mars kan leiden tot nieuwe medicijnen
Bodemontgifting op Mars kan leiden tot nieuwe medicijnen Wat zijn feiten op plantencellen?
Wat zijn feiten op plantencellen?  Opwarmend klimaat maakt tientallen jaren kennis van beschermde mariene gebieden ongedaan
Opwarmend klimaat maakt tientallen jaren kennis van beschermde mariene gebieden ongedaan Wat is het verband tussen atomen en statische elektriciteit?
Wat is het verband tussen atomen en statische elektriciteit?  Hoe we voor het eerst een mini-gammastraaluitbarsting in het laboratorium hebben gemaakt
Hoe we voor het eerst een mini-gammastraaluitbarsting in het laboratorium hebben gemaakt Wat is een grof gefolieerde rock met een banded uiterlijk genoemd?
Wat is een grof gefolieerde rock met een banded uiterlijk genoemd?  Wat is de verspilde energie in een ventilator?
Wat is de verspilde energie in een ventilator?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

