
Wetenschap
Welke elektrische krachten tussen tegengesteld geladen elektronen en protonen hebben te maken met chemische reacties?
* atomen worden bij elkaar gehouden door deze krachten: Elektronen, met hun negatieve lading, worden aangetrokken tot de positief geladen protonen in de kern van een atoom. Deze elektrostatische aantrekkingskracht houdt de elektronen gebonden aan het atoom.
* chemische bindingen worden gevormd door deze krachten: Wanneer atomen op elkaar inwerken, kunnen hun elektronen worden gedeeld of tussen hen worden overgedragen. Deze delen of overdracht wordt aangedreven door de wens om een stabielere opstelling van elektronen te bereiken, vaak door hun buitenste elektronenschalen te vullen. Deze interacties worden beheerst door elektrostatische krachten:
* Covalente bindingen: Twee atomen delen elektronen, waardoor een gebied van hoge elektronendichtheid tussen hen ontstaat. De aantrekkingskracht van beide kernen op deze elektronwolk houdt de atomen bij elkaar.
* ionische bindingen: Het ene atoom draagt een elektron over naar het andere, wat resulteert in tegengesteld geladen ionen (kationen en anionen). De elektrostatische aantrekkingskracht tussen deze ionen creëert een binding.
* chemische reacties omvatten het breken en vormen van bindingen: Chemische reacties vinden plaats wanneer moleculen botsen met voldoende energie om de elektrostatische krachten te overwinnen die hun atomen tegen elkaar houden (breken bindingen). Nieuwe bindingen kunnen zich vervolgens vormen, wat resulteert in de vorming van verschillende moleculen.
Samenvattend:
* Elektrische krachten bepalen hoe atomen zijn gestructureerd.
* Ze stimuleren de vorming van chemische bindingen, die atomen bij elkaar houden om moleculen te vormen.
* Veranderingen in deze krachten tijdens chemische reacties zorgen ervoor dat bindingen breken en vormen, wat leidt tot het creëren van nieuwe stoffen.
Hier is een eenvoudig voorbeeld:
Beschouw de reactie van natrium (Na) met chloor (CL) om tafelzout (NaCl) te vormen:
1. Natrium Heeft een enkel elektron in zijn buitenste schaal. Het wil dit elektron verliezen om een stabiele, gevulde schaal te bereiken.
2. chloor heeft zeven elektronen in zijn buitenste schaal. Het wil een elektron krijgen om een stabiele, gevulde schaal te bereiken.
3. Elektrostatische krachten spelen een rol: De sterke aantrekkingskracht tussen het positief geladen natriumion (Na+) en de negatief geladen chloride-ion (CL-) stimuleert de vorming van een ionische binding. Deze binding houdt ze bij elkaar als een molecuul natriumchloride.
Zonder de elektrische krachten tussen elektronen en protonen zouden atomen niet bestaan, en chemische reacties zoals we die ze kennen, zouden niet mogelijk zijn.
Hoofdlijnen
- In welke cel komt ademhaling op?
- Geneesmiddel blokkeert Zika- en dengue-virussen in studie
- Hoe is het nucleaire membraan als een school?
- Bij-nabootsende kaalvleugelmot zoemt na 130 jaar weer tot leven
- Wat is de stapel membranen in chloroplast?
- Welke nucleotidesequentie zou de complementaire DNA-streng vertegenwoordigen die volgt op een g c t c?
- Hoe weet je lichaam het verschil tussen dominante en recessieve genen?
- Welk proces in planten wordt niet gecontroleerd door hormonen?
- Waarom worden introns gekopieerd en vervolgens verwijderd uit de RNA -sequentie?
- Biologische signaalprocessen in intelligente materialen
- Wetenschappers ontwikkelen sondes die zijn ontworpen om de fysieke krachten in levende cellen te onthullen; een wereldprimeur

- Geautomatiseerde chemie zet nieuw tempo voor materiaalontdekking

- Nieuwe keramische nanovezelsponzen kunnen worden gebruikt voor flexibele isolatie, water Zuivering

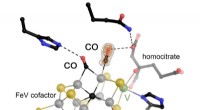
- Vanadiumafhankelijke stikstofase kan twee CO-moleculen tegelijk binden
 Lijst van peulvruchten
Lijst van peulvruchten Het proces waarbij sediment wordt afgezet heet?
Het proces waarbij sediment wordt afgezet heet?  De grootste steden van Zuid-Afrika zitten zonder water, maar de dammen zijn vol:wat is er misgegaan?
De grootste steden van Zuid-Afrika zitten zonder water, maar de dammen zijn vol:wat is er misgegaan?  Hoeveel sterren in Almanac?
Hoeveel sterren in Almanac?  Het belang van de Michael Faraday uitvinding van de elektrische motor
Het belang van de Michael Faraday uitvinding van de elektrische motor Hoeveel elektronen hebben kwantumnummers waarden n l m?
Hoeveel elektronen hebben kwantumnummers waarden n l m?  Waar wordt steenkool gevonden op aarde?
Waar wordt steenkool gevonden op aarde?  Wordt tufsteen gevormd in de oceanische korst?
Wordt tufsteen gevormd in de oceanische korst?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


