
Wetenschap
De basis van het VSEPR -model Moleculaire binding is?
Hier is een uitsplitsing:
* elektronenparen: Dit omvat zowel bindingsparen (betrokken bij covalente bindingen) en eenzame paren (niet-bindende elektronen).
* afstoting: De afstoting tussen deze elektronenparen is elektrostatisch van aard. De enige paren zijn meer verspreid en oefenen een sterkere afstotende kracht uit dan bindingsparen.
* Minimalisatie van afstoting: De elektronen rangschikken zich rond het centrale atoom op een manier die de afstoting tussen hen minimaliseert. Dit leidt tot specifieke geometrische regelingen van atomen, zoals lineaire, trigonale vlakke, tetraëdrische, trigonale bipyramidale en octaëdral.
Key Concepts:
* Het aantal elektronenparen rond het centrale atoom bepaalt de basisvorm van het molecuul.
* Lone paren hebben een groter effect op bindingshoeken dan bindingsparen.
* Het VSEPR -model biedt een relatief eenvoudige en effectieve manier om de vorm van moleculen te voorspellen.
Voorbeeld:
Beschouw het watermolecuul (h₂o):
1. Zuurstof heeft twee eenzame paren en twee bindingsparen.
2. Om afstoting te minimaliseren, worden de enige paren zo ver mogelijk van elkaar verwijderd, wat resulteert in een gebogen of V-vormige geometrie.
Samenvattend: Het VSEPR -model richt zich op de interacties tussen elektronenparen om de waargenomen vormen van moleculen te verklaren.
 Bruggen bouwen tussen atomen en hoogwaardige katalysatoren maken
Bruggen bouwen tussen atomen en hoogwaardige katalysatoren maken Is aluminium gemaakt van twee of meer metalen?
Is aluminium gemaakt van twee of meer metalen?  Is ammoniumfluoride oplosbaar in water?
Is ammoniumfluoride oplosbaar in water?  Wat is het verschil tussen micro- en macro-onderzoek op het gebied van de metallurgie?
Wat is het verschil tussen micro- en macro-onderzoek op het gebied van de metallurgie?  Strategieën voor milieuvriendelijke en duurzame polyamideproductie
Strategieën voor milieuvriendelijke en duurzame polyamideproductie
 Mudskipper-robot laat zien hoe gewervelde dieren evolueerden om op het land te lopen
Mudskipper-robot laat zien hoe gewervelde dieren evolueerden om op het land te lopen  Boeren vrezen dat het jaren zal duren om te herstellen van een stormstaking
Boeren vrezen dat het jaren zal duren om te herstellen van een stormstaking Hoe het in kaart brengen van de Galápagos duurzamere steden kan creëren
Hoe het in kaart brengen van de Galápagos duurzamere steden kan creëren Er zijn gedurfde nieuwe benaderingen nodig om de dode zone van de Golf van Mexico te verkleinen en ongrijpbare doelen te bereiken
Er zijn gedurfde nieuwe benaderingen nodig om de dode zone van de Golf van Mexico te verkleinen en ongrijpbare doelen te bereiken Ontwikkelingslanden helpen zich aan te passen aan klimaatverandering
Ontwikkelingslanden helpen zich aan te passen aan klimaatverandering
Hoofdlijnen
- Wat doen wetenschappers om een hypothese te testen?
- Deskundigen maken zich zorgen over rauw vlees-diëten voor katten en honden
- Hoe E. coli zich verdedigt tegen antibiotica
- Als een lichaamscel 22 chromosomen heeft, wat zou de telling voor reproductieve cellen zijn?
- Wat is de functie van de celwand in een wortel haarcel?
- Nobel werpt licht op paleogenetica, studie van oud DNA
- Zijn ongewervelde dieren enkele cellen of meerdere organismen?
- Lab kweekt modulaire materialen op macroschaal uit bacteriën
- Wat is het verschil tussen morfologie en morfometrie?
- Deze kunstmatige eiwitten hebben een stevige greep op metaal
- Calciumverbinding breekt zoals stoot als regel af
- Draadloos oplaadbare solid-state supercondensatoren printen voor zachte, slimme contactlenzen

- Beeldvorming van mRNA precies daar waar het is gemaakt - op de plaats van vertaling
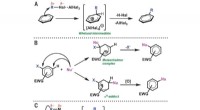
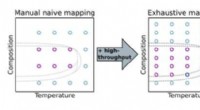
- Automatisch experimenten sturen naar wetenschappelijke ontdekkingen
 Leven op aarde:waarom hebben we de manen nu misschien een magnetisch veld ter beschikking gesteld om ervoor te bedanken
Leven op aarde:waarom hebben we de manen nu misschien een magnetisch veld ter beschikking gesteld om ervoor te bedanken Gras dat energie van de zon krijgt, is een voorbeeld van wat?
Gras dat energie van de zon krijgt, is een voorbeeld van wat?  Hoe wordt mineraal onderdeel van de grond?
Hoe wordt mineraal onderdeel van de grond?  Welke verklaring kan worden afgelegd bij het samenstellen van de chemische en fysische eigenschappen tussen een samengestelde elementen waaruit deze wordt gevormd?
Welke verklaring kan worden afgelegd bij het samenstellen van de chemische en fysische eigenschappen tussen een samengestelde elementen waaruit deze wordt gevormd?  7 van de 10 heetste landen ter wereld bevinden zich op 1 continent
7 van de 10 heetste landen ter wereld bevinden zich op 1 continent  Lichaamswarmte is door wat in de lucht overgedragen?
Lichaamswarmte is door wat in de lucht overgedragen?  Wat voor soort energie is licht?
Wat voor soort energie is licht?  Vroegste bewijs van menselijke activiteit gevonden in Amerika
Vroegste bewijs van menselijke activiteit gevonden in Amerika
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

