
Wetenschap
Wat is de relatieve ionische mobiliteit van natriumion in vergelijking met chloride -ion?
Dit is waarom:
* Grootte: Natriumionen zijn kleiner dan chloride -ionen. Dit betekent dat ze minder weerstand ervaren door de omliggende watermoleculen terwijl ze door de oplossing bewegen.
* Hydratatie: Beide ionen zijn gehydrateerd, wat betekent dat ze watermoleculen om hen heen aantrekken. Natriumionen, die kleiner zijn, hebben echter een hogere ladingsdichtheid en trekken een kleiner aantal watermoleculen aan in vergelijking met chloride -ionen. Dit resulteert in een kleinere hydratatieschil voor natriumionen, waardoor ze mobieler worden.
* opladen: Beide ionen hebben dezelfde grootte van lading (+1 voor Na+, -1 voor Cl-), maar hun grootteverschil speelt een belangrijke rol in hun mobiliteit.
Daarom hebben natriumionen een hogere relatieve ionische mobiliteit in vergelijking met chloride -ionen.
Belangrijke opmerking: Dit is een algemene verklaring. De werkelijke mobiliteit van ionen kan worden beïnvloed door factoren zoals temperatuur, concentratie en de aanwezigheid van andere ionen in de oplossing.
 Wat is de moleculaire naam voor AL2BR6?
Wat is de moleculaire naam voor AL2BR6?  Waarom is benzoëzuur enigszins oplosbaar in water?
Waarom is benzoëzuur enigszins oplosbaar in water?  Theoretische voorspelling van omgekeerde intersysteemkruising voor organische halfgeleiders
Theoretische voorspelling van omgekeerde intersysteemkruising voor organische halfgeleiders Waarom is natriummetaal reactiever dan magnesiummetaal?
Waarom is natriummetaal reactiever dan magnesiummetaal?  Welke termen beschrijven het beste het type binding in magnesiumchloride?
Welke termen beschrijven het beste het type binding in magnesiumchloride?
 Welke typen clouds hebben neerslag?
Welke typen clouds hebben neerslag?  Hawaii vulkaan laat lava borrelen, krachten 1, 500 van huizen
Hawaii vulkaan laat lava borrelen, krachten 1, 500 van huizen Boek onderzoekt hoe bomen veranderen naarmate ze ouder worden en groeien:wat vertellen deze aanwijzingen ons?
Boek onderzoekt hoe bomen veranderen naarmate ze ouder worden en groeien:wat vertellen deze aanwijzingen ons?  Naarmate meer ontwikkelingslanden de export van plastic afval afwijzen, rijke landen zoeken thuis oplossingen
Naarmate meer ontwikkelingslanden de export van plastic afval afwijzen, rijke landen zoeken thuis oplossingen Tien manieren waarop klimaatverandering bosbranden kan verergeren
Tien manieren waarop klimaatverandering bosbranden kan verergeren
Hoofdlijnen
- Een 'B12-shot' voor zeealgen? Wetenschappers vinden de groei van belangrijke eiwitalgen in de oceaan
- Kan een vrouwelijke plant alleen zaden produceren?
- Als een cel van een organisme nucleus bevat, is de eukaryote?
- Nieuwe zoomtechniek onthult voor het eerst een elektrisch circuit van cellen
- Welk type wetenschappelijk onderzoek omvat het identificeren en beheersen van variabelen?
- Hoe zal klimaatverandering het geografische bereik van salamandersoorten in de VS en Canada beïnvloeden?
- Eukaryotische celkarakteristieken
- Waarom zijn netwerken stabiel? Onderzoekers lossen een 50 jaar oude puzzel op
- Luisteren naar hoe eiwitten praten en hun taal leren
- Onderzoeksteam ontdekt verloren afbeeldingen uit de 19e eeuw

- Stabiliserende zilverfilms voor zeer efficiënte brandstofcellen

- Team gedecodeerd moleculair mechanisme dat zwermmotiliteit van bacteriële populaties remt

- Zeewier:van superfood tot supergeleider
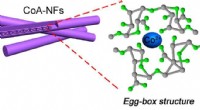
- Oude enzymen kunnen bijdragen aan groenere chemie
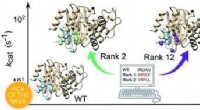
 Studie brengt ruimtestof in 3D in kaart, roept nieuwe vragen op over zijn eigenschappen in lokale en verre uithoeken van de Melkweg
Studie brengt ruimtestof in 3D in kaart, roept nieuwe vragen op over zijn eigenschappen in lokale en verre uithoeken van de Melkweg Wanneer een zuur reageert met een basis wat ze doen?
Wanneer een zuur reageert met een basis wat ze doen?  Waarom hebben gasvormige planeten meer manen dan terrestrische planeten?
Waarom hebben gasvormige planeten meer manen dan terrestrische planeten?  Wat is het belangrijkste criterium voor het classificeren van detritale sedimentaire rotsen?
Wat is het belangrijkste criterium voor het classificeren van detritale sedimentaire rotsen?  Simuleren van meteorietinslagen in het laboratorium
Simuleren van meteorietinslagen in het laboratorium Stuk lithosfeer met een unieke geologische geschiedenis?
Stuk lithosfeer met een unieke geologische geschiedenis?  Hoeveel watt gebruikt een tablet?
Hoeveel watt gebruikt een tablet?  Hoe lijkt een celanalogie op catwalk?
Hoe lijkt een celanalogie op catwalk?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

