
Wetenschap
Zouden zink- en ijzernitraat reageren?
* zink is reactiever dan ijzer. Dit betekent dat zink ijzer uit zijn compound zal verplaatsen.
* enkele verplaatsingsreactie: Deze reactie is een klassiek voorbeeld van een enkele verplaatsingsreactie, waarbij een meer reactief element een minder reactief element in een verbinding vervangt.
De reactie:
Zn (s) + Fe (no₃) ₂ (aq) → Zn (no₃) ₂ (aq) + fe (s)
Verklaring:
* Zink (Zn) is een massief metaal.
* IJzernitraat (Fe (No₃) ₂) is een waterige oplossing (opgelost in water).
* De reactie resulteert in de vorming van zinknitraat (Zn (no₃) ₂) in oplossing en vast ijzer (Fe).
Observaties:
* U zou waarschijnlijk de vorming zien van een grijs/bruine vaste stof (ijzer) terwijl het zink reageert met de ijzernitraatoplossing.
* De oplossing kan van kleur veranderen als het ijzernitraat wordt geconsumeerd en zinknitraatvormen.
Belangrijke opmerking: De reactiesnelheid zal afhangen van het oppervlak van het zink, de concentratie van de ijzernitraatoplossing en de temperatuur.
 Onderzoekers onderzoeken voordelen van grazende schapen in de groenteteelt
Onderzoekers onderzoeken voordelen van grazende schapen in de groenteteelt Hoe zou de bodem in een tropisch regenwoud verschillen van bossen met een nat seizoen en een droog seizoen?
Hoe zou de bodem in een tropisch regenwoud verschillen van bossen met een nat seizoen en een droog seizoen?  Een vuurspuwende draak helpt bij het bestrijden van aanvallen van sintels op gebouwen met rieten daken
Een vuurspuwende draak helpt bij het bestrijden van aanvallen van sintels op gebouwen met rieten daken Wat is het verschil tussen cryosfeer en hydrosfeer?
Wat is het verschil tussen cryosfeer en hydrosfeer?  Mensen verantwoordelijk voor het grootste deel van het verlies van Arctisch zee-ijs:studie
Mensen verantwoordelijk voor het grootste deel van het verlies van Arctisch zee-ijs:studie
Hoofdlijnen
- Lichaamsdelen in twee verschillende dieren die een vergelijkbare structuur zijn, wordt gezegd?
- Wat maakt DNA-vingerafdrukken uniek?
- Studie werpt licht op hoe betere bacteriofaagtherapieën kunnen worden ontwikkeld
- Wat is gecombineerde wetenschappen?
- Kunnen huisdieren apenpokken krijgen? Het komt zelden voor, maar experts zeggen ja:dit is wat u moet weten
- Hoe sociale media de menselijke beschaving hebben gesynchroniseerd
- Wat delen mitose en meiose in vergelijking?
- Wat is een polycule? Een expert op het gebied van polyamorie legt het uit
- Hoe heeft Florida niet gereageerd op een epizoötische koraalziekte en wat volgt?
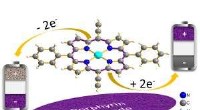
- Natuurlijk molecuul om de prestaties van elektroden voor oplaadbare batterijen te verbeteren
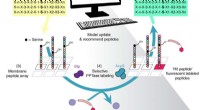
- Machine learning gebruiken om peptiden te ontwerpen
- Het plaatje van micronutriënten voor plantaardige melkalternatieven compleet

- Met behulp van twee CRISPR-enzymen, een COVID-diagnose in slechts 20 minuten

- Nieuw waargenomen eenwaardige calciumionen vertonen onverwachte metaalachtigheid en ferromagnetisme
 Waarschuwing afgegeven aan industriële installaties nu Triton-hack weer opduikt
Waarschuwing afgegeven aan industriële installaties nu Triton-hack weer opduikt Ford sluit drie fabrieken, stop met het maken van personenauto's in Rusland
Ford sluit drie fabrieken, stop met het maken van personenauto's in Rusland Hoe creëert getijden energie?
Hoe creëert getijden energie?  Hoe verhoudt de leeftijd van het universum zich tot de hubble-constante?
Hoe verhoudt de leeftijd van het universum zich tot de hubble-constante?  Wat is de verhouding natrium-chloorzout?
Wat is de verhouding natrium-chloorzout?  Welk type verwering zorgt ervoor dat de minerale samenstellingsrots verandert?
Welk type verwering zorgt ervoor dat de minerale samenstellingsrots verandert?  Zeer gevoelige nanosensor detecteert subtiele kaliumveranderingen in de hersenen
Zeer gevoelige nanosensor detecteert subtiele kaliumveranderingen in de hersenen Kosmisch stof had kunnen helpen het leven op aarde op gang te brengen
Kosmisch stof had kunnen helpen het leven op aarde op gang te brengen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

