
Wetenschap
Aantal covalente bindingen in stikstof?
Stikstof (n) vormt drie covalente bindingen .
Dit is waarom:
* stikstof heeft 5 valentie -elektronen . Dit zijn de elektronen in de buitenste schaal die deelnemen aan binding.
* Om een stabiel octet te bereiken (8 elektronen in de buitenste schaal), moet stikstof 3 meer elektronen krijgen .
* stikstof vormt covalente bindingen door zijn elektronen te delen met andere atomen . Hierdoor kan elk stikstofatoom 8 elektronen effectief "bezitten".
Daarom vormt stikstof typisch drie covalente bindingen om een stabiele elektronenconfiguratie te bereiken. Daarom ziet u stikstof in verbindingen zoals ammoniak (NH3) en stikstofgas (N2).
 Hoe gedragen de elektronen zich in een mineraal met metalen binding?
Hoe gedragen de elektronen zich in een mineraal met metalen binding?  Een vriendelijkere manier om met nitraatvervuiling om te gaan
Een vriendelijkere manier om met nitraatvervuiling om te gaan Hoeveel mol bariumchloride bevindt zich in 1,5 liter A 0,256 molaire oplossing?
Hoeveel mol bariumchloride bevindt zich in 1,5 liter A 0,256 molaire oplossing?  Wetenschappers laten zien hoe vloeibare brandstoffen in polymere gels kunnen worden opgeslagen om explosies en branden te voorkomen
Wetenschappers laten zien hoe vloeibare brandstoffen in polymere gels kunnen worden opgeslagen om explosies en branden te voorkomen  Wat is een verbinding die hyroniumionen in water produceert?
Wat is een verbinding die hyroniumionen in water produceert?
Hoofdlijnen
- Hoe biologische landbouw werkt
- Wat is geheime pseudo -eiwitcode?
- Wat reguleert lichamelijke functies en enzymen?
- Wat is fitosynthese?
- Welke theorieën verklaren de evolutie van geslacht en ontwikkeling?
- Dobbelsteenslangen bleken verschillende technieken te gebruiken om hun eigen dood effectiever te simuleren
- UITLEG:Wat maakt zangvogels uit het midden van de Atlantische Oceaan ziek?
- Invasieve kikkers geven invasieve vogels een boost op Hawaï
- Kunnen boerderijen maximaal produceren en toch de uitstoot van broeikasgassen verminderen?
- Betaalbare loodsensor voor thuis, stadswaterleidingen

- Wetenschappers ontwerpen moleculair systeem voor kunstmatige fotosynthese
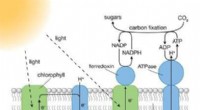
- Nieuw type sensormateriaal ontwikkeld
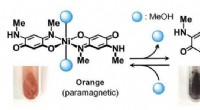
- Nieuwe bevindingen over het effect van Epsom-zout - Epsom-zoutreceptor geïdentificeerd
- Gecontroleerde fabricage van multimetalen bouwstenen voor hybride nanomaterialen

 Wat heeft meer biomassa voor fotosynthetisch weefsel en minder ondersteunend weefsel?
Wat heeft meer biomassa voor fotosynthetisch weefsel en minder ondersteunend weefsel?  Klimaatverandering zal de komende decennia voor meer zwarte zaterdagen zorgen
Klimaatverandering zal de komende decennia voor meer zwarte zaterdagen zorgen Wiskunde gebruiken om muzieknoten naadloos te laten samenvloeien
Wiskunde gebruiken om muzieknoten naadloos te laten samenvloeien Wat gebruikt de transformatie van de microgolfenergietransformatie?
Wat gebruikt de transformatie van de microgolfenergietransformatie?  Hoe de jacht mensen tot langeafstandslopers heeft gemaakt
Hoe de jacht mensen tot langeafstandslopers heeft gemaakt  Welke kleurster is de grootste?
Welke kleurster is de grootste?  Nucleaire reacties produceren enorme energie afkomstig van de hoeveelheden waar doet dit?
Nucleaire reacties produceren enorme energie afkomstig van de hoeveelheden waar doet dit?  Hoe voorspellen spaghettimodellen een orkanenpad?
Hoe voorspellen spaghettimodellen een orkanenpad?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

