
Wetenschap
Als de stof een molaire massa van 160 plus 5 gram per mol heeft, wat is de moleculaire formule?
* molaire massa vertelt u slechts de totale massa van één mol van de stof. Het vertelt u niet welke elementen aanwezig zijn of in welke verhoudingen.
* Veel verschillende moleculen kunnen dezelfde molaire massa hebben. Een molecuul met 10 koolstofatomen en 10 waterstofatomen zou bijvoorbeeld een andere formule hebben dan een molecuul met 5 koolstofatomen en 20 waterstofatomen, maar ze kunnen dezelfde molaire massa hebben.
Om de moleculaire formule te bepalen, heeft u aanvullende informatie nodig, zoals:
* Elementaire analyse: Dit vertelt u de percentages van elk element in de compound.
* Spectroscopische gegevens: Technieken zoals infrarood (IR) of nucleaire magnetische resonantie (NMR) spectroscopie bieden informatie over de structuur van het molecuul.
Voorbeeld:
Laten we zeggen dat u weet dat de molaire massa 165 g/mol is en u weet dat de stof alleen koolstof en waterstof bevat. Misschien kunt u de moleculaire formule afleiden:
1. Bereken de empirische formule: De empirische formule vertegenwoordigt de eenvoudigste verhouding van het hele nummer van atomen in een verbinding. U kunt dit doen door 100 g van de stof aan te nemen en de percentages koolstof en waterstof om te zetten in gram. Verdeel die massa's vervolgens door de atomaire massa's koolstof en waterstof om de molverhouding te krijgen.
2. Bepaal de moleculaire formule: Vergelijk de molaire massa van de empirische formule met de bekende molaire massa van de stof. De moleculaire formule is een veelvoud van de empirische formule.
Onthoud: U hebt meer informatie nodig dan alleen de molaire massa om de moleculaire formule te vinden.
 Simulaties van de opwarming van de aarde:delen van het VK en Noord-Europa zien meer samengestelde overstromingen
Simulaties van de opwarming van de aarde:delen van het VK en Noord-Europa zien meer samengestelde overstromingen Harvey begon met razende wind, maar zijn erfenis zal water zijn
Harvey begon met razende wind, maar zijn erfenis zal water zijn Welk type milieuwetenschappelijk carrière omvat het verzamelen van informatie over hoe menselijke gebeurtenissen het milieu beïnvloeden?
Welk type milieuwetenschappelijk carrière omvat het verzamelen van informatie over hoe menselijke gebeurtenissen het milieu beïnvloeden?  Nieuw onderzoek naar noorderlicht zal de nauwkeurigheid van satellietnavigatie verbeteren
Nieuw onderzoek naar noorderlicht zal de nauwkeurigheid van satellietnavigatie verbeteren Wat is rechter oude rivieren of jonge rivieren?
Wat is rechter oude rivieren of jonge rivieren?
Hoofdlijnen
- Welke soorten dieren eten balpythons?
- Welke rol speelt bioloog bij het redden van ons tropische regenwoud?
- Nieuw model bevestigt dat bedreigde rechtse walvissen afnemen
- Welke cyclus produceert de meeste NADH?
- Lijst met genotypes
- Waar werken en wonen wetenschappers?
- Waarom planten spruiten vormen in het donker
- Wat doet een kern in cel?
- Malariaparasiet verpakt genetisch materiaal voor reis van muggen naar mensen
- Een eenvoudigere manier om B-cellen en T-cellen te differentiëren
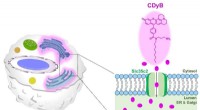
- Geïnspireerd door de natuur, het onderzoek om een nieuw dragend materiaal te ontwikkelen
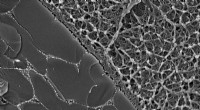
- Paleofarmaceutica uit Baltisch barnsteen kunnen resistente infecties bestrijden

- 'S Werelds kleinste sensor meet groeikracht van planten, dieren en mensen

- Interfacial engineering core@shell nanodeeltjes voor actieve en selectieve directe H2O2-generatie
 Hoe worden wetenschappelijke gegevens gebruikt als bewijs om theorieën te ontwikkelen, de oorsprong van het universum beschrijven?
Hoe worden wetenschappelijke gegevens gebruikt als bewijs om theorieën te ontwikkelen, de oorsprong van het universum beschrijven?  Wat zijn mycosterolen?
Wat zijn mycosterolen?  Wat werd het raster gebruikt om overervingpatronen op basis van genotype -ouders die werden genoemd?
Wat werd het raster gebruikt om overervingpatronen op basis van genotype -ouders die werden genoemd?  Welke eigenschappen worden meestal gebruikt om metamorfe rotsen te onderscheiden van andere soorten rotsen?
Welke eigenschappen worden meestal gebruikt om metamorfe rotsen te onderscheiden van andere soorten rotsen?  Wat is de basiciteit van fosforzuur?
Wat is de basiciteit van fosforzuur?  Alt-Labour invullen waar vakbonden niet kunnen
Alt-Labour invullen waar vakbonden niet kunnen Hoe helpt natuurkunde uw leven te verbeteren?
Hoe helpt natuurkunde uw leven te verbeteren?  Wat was het kortste experiment in de wetenschappelijke geschiedenis?
Wat was het kortste experiment in de wetenschappelijke geschiedenis?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

