
Wetenschap
Wat is de dichtheid in G L van chloorgas bij 7,50 102 Torr en 25,0ºC molmassa is gelijk aan 70,9 mol?
1. Converteer druk naar atmosferen
* 1 ATM =760 TORR
* 7,50 x 10² torr * (1 atm / 760 torr) =0.987 ATM
2. Converteer de temperatuur naar Kelvin
* K =° C + 273.15
* 25.0 ° C + 273.15 =298.15 K
3. Gebruik de ideale gaswet
De ideale gaswet is:PV =NRT
* P =druk (in atm) =0,987 atm
* V =volume (in l)
* n =mol gas
* R =ideale gasconstante =0,0821 l ATM/MOL K K
* T =temperatuur (in k) =298,15 k
We willen de dichtheid (ρ) vinden, die massa (m) per volume -eenheid is (v):
* ρ =m/v
We kunnen de ideale gaswet herschikken om op te lossen voor dichtheid:
* n/v =p/rt
* Omdat n =m/m (waarbij m molmassa is), kunnen we vervangen:
* (m/m)/v =p/rt
* ρ =(m/v) =(pm)/rt
4. Bereken de dichtheid
* ρ =(0.987 atm * 70,9 g/mol)/(0.0821 l ATM/MOL K * 298.15 K)
* ρ ≈ 2,84 g/l
Daarom is de dichtheid van chloorgas bij 7,50 x 10² Torr en 25,0 ° C ongeveer 2,84 g/l.
 Hoe regenwormen zichzelf beschermen
Hoe regenwormen zichzelf beschermen  Groenblijvende naalden fungeren als luchtkwaliteitsmonitors
Groenblijvende naalden fungeren als luchtkwaliteitsmonitors Studie biedt inzichten voor het in kaart brengen van kustsqueeze-effecten op historische, natuurlijke sites
Studie biedt inzichten voor het in kaart brengen van kustsqueeze-effecten op historische, natuurlijke sites Alle abiotische en biotische factoren in een kleine bosvormen?
Alle abiotische en biotische factoren in een kleine bosvormen?  koude voorspelling, vallende leguanen in petto voor Florida Xmas
koude voorspelling, vallende leguanen in petto voor Florida Xmas
Hoofdlijnen
- Wat zijn de aminozuursubeenheden?
- Bacteriën levenscyclus
- Life Science staat ook bekend als?
- Science Fair-projecten met nagellak
- Wat stellen wetenschappers voor en testen om tot een oplossing te komen?
- Wanneer twee geslachtscellen samenkomen, hoeveel chromosomen heeft nakomelingen?
- Australië vermeldt kleine wallaby onder nieuwe bedreigde diersoorten
- In welk biome leven mensen?
- Wat is een vrijgesteld menselijk exemplaar?
- Hoe receptoren voor medicijnen in cellen werken
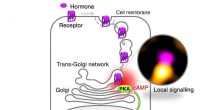
- Hoe het proces van polymeerextrusie te optimaliseren

- Neutronendiffractie-experimenten van materialen met structuren die meerdere metalen elementen bevatten

- Natuurlijk mineraal hackmaniet vertoont een zeer herhaalbaar kleurveranderingsvermogen

- Efficiënte kettingoverdracht voor 3D-printen van taaie fotopolymeren

 Wat is een reagerende variabele in wetenschappelijke projecten?
Wat is een reagerende variabele in wetenschappelijke projecten?
Wetenschappers ontwerpen experimenten om te zoeken naar oorzaak-en-gevolg relaties; waar veranderingen in één ding een voorspelbare verandering in iets anders kunnen veroorzaken. Deze
 Nieuwe methode maakt geautomatiseerd snel onderzoek van enzymatische processen mogelijk
Nieuwe methode maakt geautomatiseerd snel onderzoek van enzymatische processen mogelijk Welke energietransformatie in fluorescentielamp?
Welke energietransformatie in fluorescentielamp?  Wat is de bron van koolstof voor ademhaling?
Wat is de bron van koolstof voor ademhaling?  Hoe klimaatbewuste Amerikanen hun ecologische voetafdruk verkleinen
Hoe klimaatbewuste Amerikanen hun ecologische voetafdruk verkleinen  Verbeterd begrip van baanbrekende vloeibaar-metaal 2D-techniek
Verbeterd begrip van baanbrekende vloeibaar-metaal 2D-techniek Geen grond achtergelaten:hoe een kosteneffectieve technologie arme velden kan verrijken
Geen grond achtergelaten:hoe een kosteneffectieve technologie arme velden kan verrijken  Welke vorm van energie heeft turbinebladen?
Welke vorm van energie heeft turbinebladen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

