
Wetenschap
Waarom wordt een natriumatoom stabieler wanneer het één valentie -elektron verliest?
* octetregel: Atomen streven ernaar een stabiele elektronenconfiguratie te bereiken, die lijken op de edelgassen. Nobele gassen hebben een volledige buitenste schaal van elektronen, waardoor ze zeer niet -reactief zijn. De octetregel stelt dat atomen de neiging hebben om elektronen te winnen, verliezen of delen om acht elektronen in hun buitenste schaal te hebben.
* Natrium's elektronenconfiguratie: Natrium (NA) heeft 11 elektronen. De elektronenconfiguratie is 2, 8, 1. Dit betekent dat het één elektron heeft in de buitenste schaal (valentieschaal).
* Een elektron verliezen: Door zijn enkele valentie -elektron te verliezen, wordt natrium een positief geladen ion (Na+). De nieuwe elektronenconfiguratie is 2, 8, die overeenkomt met de stabiele elektronenconfiguratie van neon (NE), een edelgas.
* stabiliteit door gevulde schelpen: Het hebben van een volledige buitenste schaal maakt natrium stabieler omdat:
* Het elimineert de neiging om te reageren met andere atomen om elektronen te verkrijgen of te delen om een volledige buitenste schaal te bereiken.
* De elektrostatische aantrekkingskracht tussen de kern en de resterende elektronen is sterker, waardoor het ion stabieler wordt.
Samenvattend: Natrium verliest zijn valentie -elektron om een stabiele octetconfiguratie zoals neon te bereiken, waardoor het stabieler en minder reactiever wordt.
 Hoeveel mol zuurstof zit er in 3,70 NaClO4?
Hoeveel mol zuurstof zit er in 3,70 NaClO4?  Welke moleculen hebben een ongelijke lading met meer negatief aan de zijkant en positieve andere?
Welke moleculen hebben een ongelijke lading met meer negatief aan de zijkant en positieve andere?  Welke deeltjes in zout rangschikken zichzelf een geometrische vorm Wat A.Crystals B.Atoms C.Elements D.Electrons?
Welke deeltjes in zout rangschikken zichzelf een geometrische vorm Wat A.Crystals B.Atoms C.Elements D.Electrons?  Waar komt de meeste zuurstof vandaan?
Waar komt de meeste zuurstof vandaan?  Waarmee reageert boor?
Waarmee reageert boor?
 Onderzoekers bestuderen hoe mensen denken over wat wel en niet riskant is
Onderzoekers bestuderen hoe mensen denken over wat wel en niet riskant is  'S Werelds grootste terrestrische koolstofputten zijn te vinden in jonge bossen
'S Werelds grootste terrestrische koolstofputten zijn te vinden in jonge bossen Visdiversiteit gekoppeld aan de gezondheid van Caribische koraalriffen
Visdiversiteit gekoppeld aan de gezondheid van Caribische koraalriffen 10 dingen die u kunt doen om de aarde te helpen redden
10 dingen die u kunt doen om de aarde te helpen redden  Het vuur van Getty in Zuid-Californië blijft branden
Het vuur van Getty in Zuid-Californië blijft branden
Hoofdlijnen
- Wat is een trangenisch organisme?
- Wat zijn aerosol in de microbiologie en hoe deze te minimaliseren?
- Waarom zijn er blaasjes in puim en scoria?
- Welk macromolecuul is verantwoordelijk voor het richten van de groei van het levende organisme?
- Zijn dieren zo slim of dom als we denken dat ze zijn?
- Team onthult regels voor het maken van ribben
- Wat doet een luchtpijpcel?
- Een mitose-mysterie opgelost:hoe chromosomen perfect uitgelijnd zijn in een delende cel
- 'S Werelds botanische tuinen bevatten een derde van alle bekende plantensoorten, en help de meest bedreigde te beschermen
- Experimenten en analyses laten zien hoe elektronen en protonen samenkomen op een elektrodeoppervlak
- Onderzoek verbetert theorieën over ionenverdamping en prestaties van elektrospraytoepassingen
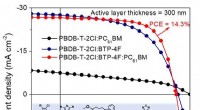
- Meer dan 14% efficiëntie voor ternaire organische zonnecel met 300 nm dikke actieve laag
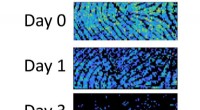
- Residuen in vingerafdrukken bevatten aanwijzingen voor hun leeftijd
- Evolutie hacken, screeningstechniek kan het meest wijdverbreide enzym verbeteren

 NASA-instrumentsleutel voor begrip van planeet op zonne-energie arriveert in Kennedy Space Center
NASA-instrumentsleutel voor begrip van planeet op zonne-energie arriveert in Kennedy Space Center Nieuwe aanpak kan COVID-19-voorspellingen wereldwijd verbeteren
Nieuwe aanpak kan COVID-19-voorspellingen wereldwijd verbeteren De opkomst van anti-Aziatische haatmisdrijven tijdens de COVID-19-pandemie
De opkomst van anti-Aziatische haatmisdrijven tijdens de COVID-19-pandemie Designer nanodeeltjes vernietigen een breed scala aan virussen
Designer nanodeeltjes vernietigen een breed scala aan virussen Wat omvat een bewegende richting en snelheid?
Wat omvat een bewegende richting en snelheid?  Wat toont het juiste bestelformulier van klein naar groot?
Wat toont het juiste bestelformulier van klein naar groot?  NASA-NOAA-satelliet vindt Tropical Storm Mario meer uit vorm
NASA-NOAA-satelliet vindt Tropical Storm Mario meer uit vorm Hoeveel atomen zitten er in 4CaCo3?
Hoeveel atomen zitten er in 4CaCo3?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

