
Wetenschap
Kun je BACL2 Plus K2SO4 balanceren gelijk is aan BASO4 KCL?
Onevenwichtige vergelijking:
BACL₂ + K₂SO₄ → BASO₄ + KCL
het balanceren van de vergelijking:
1. Begin met de meest complexe verbinding: In dit geval is het Baso₄. Er is één BA, één en vier O -atomen aan de productzijde. We moeten dat matchen aan de reactantzijde.
2. Balans BA: Er is één BA -atoom aan elke kant, dus het is al in balans.
3. Balans S: Er is een S -atoom aan elke kant, dus deze is al in balans.
4. Balans o: Er zijn vier O -atomen aan elke kant, dus het is al in balans.
5. Balans K: Er zijn twee K -atomen aan de reactantzijde en slechts één aan de productzijde. Voeg een coëfficiënt van 2 toe voor KCL.
6. Balans Cl: Er zijn twee CL -atomen aan de reactantzijde en nu twee aan de productkant dankzij de coëfficiënt die in de vorige stap is toegevoegd.
Balanced vergelijking:
BACL₂ + K₂SO₄ → BASO₄ + 2KCL
 De utilitaire benadering van het wereldwijde klimaatbeleid verbetert de rechtvaardigheid, milieu en welzijn
De utilitaire benadering van het wereldwijde klimaatbeleid verbetert de rechtvaardigheid, milieu en welzijn Is Pine Mountain een constructieve of destructieve krachten?
Is Pine Mountain een constructieve of destructieve krachten?  30 doden door bosbranden in Portugal en Spanje
30 doden door bosbranden in Portugal en Spanje Welke soorten lieveheersbeestjes zijn er?
Welke soorten lieveheersbeestjes zijn er?  Meanderende rivieren creëren contrapunten, ongeacht de onderliggende geologie
Meanderende rivieren creëren contrapunten, ongeacht de onderliggende geologie
Hoofdlijnen
- Ontbrekende tenen van grizzlyberen resulteren in oproep om praktijken te veranderen
- Welk kenmerk vindt plaats in alle systemen het lichaam?
- Wat is de functie van vetcel?
- Waarom verspreiden bloeiende planten hun zaden?
- Hoe een spanningssensor een integrale rol speelt bij de uitgelijnde chromosoompartitie
- Wat is de classificatie van een Colorado -kever?
- Orkaan verscheurde het gerenommeerde onderzoekscentrum van Monkey Island
- Wat bedoel je met illusie in termen van biologie?
- Wat transporteert vaste deeltjes in een cel?
- Onderzoekers ontwikkelen nieuwe bijna-ultraviolette LED-prikkelbare nabij-infraroodstralers
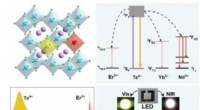
- Moleculaire simulaties gebruiken om zelf-assemblerende, associërende polymeren te bestuderen

- Nanogestructureerde materialen op siloxaanbasis voor nieuwe kunststoffen en micro-elektronica

- Moleculair magnetisme combineert kracht met boodschapperelektron

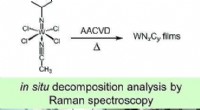
- Gesimuleerde chemische dampafzetting van een wolfraamcarbonitride-precursor
 Hoor dit:Apple zei nieuwe, high-end AirPods in de maak
Hoor dit:Apple zei nieuwe, high-end AirPods in de maak Met welke snelheid golven in ruimtevaart lichtgolven?
Met welke snelheid golven in ruimtevaart lichtgolven?  Effectiviteit op lange termijn van beheerde bosbranden bij herstelwerkzaamheden
Effectiviteit op lange termijn van beheerde bosbranden bij herstelwerkzaamheden Het probleem van plasticvervuiling kan grotere gevolgen hebben dan we denken
Het probleem van plasticvervuiling kan grotere gevolgen hebben dan we denken Website voor het delen van gegevens kan de reactie op nieuwe illegale drugs versnellen
Website voor het delen van gegevens kan de reactie op nieuwe illegale drugs versnellen Hoe beïnvloedt de waterstofbinding het kookpunt van water?
Hoe beïnvloedt de waterstofbinding het kookpunt van water?  What is in side earth?
What is in side earth?  Wanneer is de zon hier direct boven het hoofd in Levittown NY?
Wanneer is de zon hier direct boven het hoofd in Levittown NY?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

