
Wetenschap
Waarom zijn dipoolinteracties zwak?
* Afstandsafhankelijkheid: De sterkte van dipool-dipoolinteracties neemt snel af met afstand. Dit komt omdat de aantrekkingskracht tussen de positieve en negatieve uiteinden van de dipolen verzwakt naarmate de afstand tussen hen toeneemt. Dit maakt ze veel zwakker dan ionische of covalente bindingen, die veel sterkere krachten hebben.
* Oriëntatieafhankelijkheid: Dipool-dipoolinteracties zijn ook sterk afhankelijk van de oriëntatie van de moleculen. De sterkste interacties treden op wanneer het positieve uiteinde van het ene molecuul is uitgelijnd met het negatieve uiteinde van het andere. Thermische beweging verstoort deze uitlijningen echter constant, waardoor de interactie gemiddeld wordt verzwakt.
* magnitude van dipoolmoment: De sterkte van de interactie is ook recht evenredig met de grootte van het dipoolmoment van het molecuul. Moleculen met grotere dipoolmomenten zullen sterkere interacties hebben. Zelfs met grote dipoolmomenten zijn de interacties echter nog steeds relatief zwak in vergelijking met andere soorten intermoleculaire krachten.
Vergelijking van andere interacties:
* Covalente bindingen: Deze omvatten het delen van elektronen en zijn aanzienlijk sterker dan dipool-dipoolinteracties.
* ionische bindingen: Deze omvatten de elektrostatische aantrekkingskracht tussen ionen en zijn ook veel sterker dan dipool-dipool-interacties.
* Waterstofbindingen: Hoewel nog steeds zwakker dan covalente en ionische bindingen, zijn waterstofbindingen sterker dan dipool-dipool-interacties vanwege het sterke elektronegativiteitsverschil tussen waterstof en het andere betrokken atoom.
Samenvattend:
* Dipool-dipoolinteracties zijn zwak omdat ze vertrouwen op zwakkere elektrostatische krachten in vergelijking met covalente of ionische bindingen.
* De interacties zijn gevoelig voor afstand en oriëntatie, waardoor ze gemiddeld nog zwakker zijn vanwege thermische beweging.
* De omvang van het dipoolmoment beïnvloedt de sterkte, maar zelfs met grote dipolen blijven de interacties relatief zwak.
Het is belangrijk om te onthouden dat, hoewel zwakke interacties tussen dipool-dipool nog steeds belangrijk zijn in veel chemische en biologische processen. Ze dragen bij aan de eigenschappen van vloeistoffen, beïnvloeden de smeltende en kookpunten van moleculen en spelen een rol bij het vouwen van eiwitten en moleculaire herkenning.
Hoofdlijnen
- Gentherapie helpt honden met spierdystrofie, mensen daarna?
- Maakt religie een verschil in de politiek?
- Uit onderzoek blijkt dat het verlies van grote herbivoren de interacties tussen planten en hun natuurlijke vijanden beïnvloedt
- Zijn geiten wattles een dominante of recessieve eigenschap?
- Kan een robot leren navigeren als een kakkerlak?
- Uitvindingen van de evolutie:wat kikkers een gezicht geeft
- Welke rol speelt water in de voedselproductie van planten?
- Hoe cellulaire vingertoppen cellen kunnen helpen met elkaar te ‘praten’
- Wat kikkerverkering ons kan vertellen over menselijke praatjes
- Nieuwe eigenschap van polymeer kan toegankelijke zonne-energie stimuleren

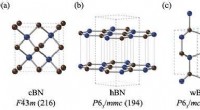
- De meest stabiele boornitridestructuur voorspellen met kwantumsimulaties
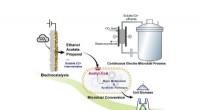
- Team ontwerpt systeem om bioplastics te maken
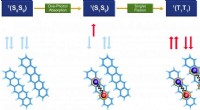
- Baanbrekende kwantumchemietechniek voor computationeel ontwerp en optimalisatie van organische fotofunctionele materialen
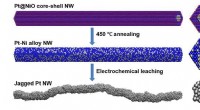
- Ruwe oppervlakken bieden extra locaties voor energieopwekkende reacties in brandstofcellen
 McDonalds schakelt Alexa en Google in om te helpen bij het aannemen van personeel
McDonalds schakelt Alexa en Google in om te helpen bij het aannemen van personeel Hoge performantie, lichtgewicht supercondensatorelektroden van de toekomst
Hoge performantie, lichtgewicht supercondensatorelektroden van de toekomst Test op aanwezigheid van water in watervrij kopersulfaat?
Test op aanwezigheid van water in watervrij kopersulfaat?  Japanse SoftBank investeert 900 miljoen euro in Duitse Wirecard
Japanse SoftBank investeert 900 miljoen euro in Duitse Wirecard Hoe is het verbranden van een marshmellow chemische verandering?
Hoe is het verbranden van een marshmellow chemische verandering?  Een gouden kogel voor kanker:nanodeeltjes zorgen voor een gerichte versie van fotothermische therapie voor kanker
Een gouden kogel voor kanker:nanodeeltjes zorgen voor een gerichte versie van fotothermische therapie voor kanker Nieuwe beeldvormingsmethode geeft live inzicht in hoe cellen werken
Nieuwe beeldvormingsmethode geeft live inzicht in hoe cellen werken  Hoe kan ik de Poolster aan de nachtelijke hemel vinden?
Hoe kan ik de Poolster aan de nachtelijke hemel vinden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


