
Wetenschap
Hoe worden natrium en chloor stabiel?
* natrium (NA): Heeft één elektron in zijn buitenste schaal. Het wil dit elektron verliezen om een stabiel octet (8 elektronen) in zijn buitenste schaal te bereiken.
* chloor (CL): Heeft zeven elektronen in zijn buitenste schaal. Het wil één elektron winnen om een stabiel octet te bereiken.
Het proces:
1. Natrium (NA) verliest zijn ene buitenste elektron en wordt een positief geladen ion genaamd natriumion (Na+) .
2. chloor (CL) Wint het elektron dat natrium verliest en wordt een negatief geladen ion genaamd chloride-ion (Cl-) .
3. tegengestelde kosten trekken aan. Het positief geladen natriumion en het negatief geladen chloride -ion worden tot elkaar aangetrokken en vormen een sterke elektrostatische aantrekkingskracht.
Het resultaat:
* De resulterende verbinding, natriumchloride (NaCl), is een stabiele ionische verbinding met een neutrale lading. De octetregel is voldaan voor zowel natrium als chloor, waardoor ze stabiel zijn.
Sleutelpunten:
* ionische bindingen: Komen op tussen metalen (zoals natrium) en niet -metalen (zoals chloor).
* octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie van acht elektronen in hun buitenste schaal te bereiken.
* Elektrostatische aantrekkingskracht: De kracht die de tegengesteld geladen ionen bij elkaar houdt in een ionische binding.
Laat het me weten als je meer informatie wilt over een van deze punten!
 Waarom is de kracht uit balans als er een appel aan een boom hangt?
Waarom is de kracht uit balans als er een appel aan een boom hangt?  Verschillen tussen waterlichamen
Verschillen tussen waterlichamen Het is een wereld van vissen die bomen eet:onderzoek vindt brede steun dat meren worden gevoed door hun stroomgebieden
Het is een wereld van vissen die bomen eet:onderzoek vindt brede steun dat meren worden gevoed door hun stroomgebieden Wat is de creatie?
Wat is de creatie?  NASA volgt Tropical Storm Sanba terwijl het Filippijnse waarschuwingen activeert
NASA volgt Tropical Storm Sanba terwijl het Filippijnse waarschuwingen activeert
Hoofdlijnen
- Branch of Science die zich bezighoudt met frequentie- en distributieziekten wordt genoemd?
- Freeze frame:Onderzoekers lossen op hoe cellen eiwitten ontvouwen
- Revolutionaire microscoop- en labeltechniek brengt DNA-mutaties in kaart
- De circadiane klok bepaalt het tempo van de plantengroei
- Waar bevinden zich de kupfferscellen?
- Morfogenese in planten is het gevolg van wat?
- Bloedmonsters tonen aan dat dodelijke kikkerschimmel in het wild aan het werk is
- Nieuwe ontdekking daagt lang gekoesterde evolutietheorie uit
- Welke speciale informatie geeft het molecuulmodel van de bal en het stick?
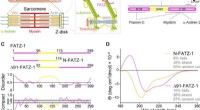
- Orde van wanorde in de sarcomeer
- nieuwe efficiënte, lage-temperatuurkatalysator voor waterstofproductie

- Nieuwe technologie om bittere amandelen in realtime te detecteren

- Minimalisering van blootstelling aan schadelijke vlamvertragende chemicaliën in afvalschuim en kunststoffen

- Nieuwe familie van selectieve op zilver gebaseerde geneesmiddelen tegen kanker ontdekt
 Hoe helpen laboratoriumtools de waarnemingen van wetenschapper te verbeteren?
Hoe helpen laboratoriumtools de waarnemingen van wetenschapper te verbeteren?  Welk land is 80 North en 20 oost?
Welk land is 80 North en 20 oost?  Waar was de eerste dierentuin ter wereld?
Waar was de eerste dierentuin ter wereld?  Wetenschappers verbeteren diagnose alvleesklierkanker met multifunctionele platina-nanoreactor
Wetenschappers verbeteren diagnose alvleesklierkanker met multifunctionele platina-nanoreactor Hebben gassen en vloeistoffen dezelfde samendrukbaarheidseigenschap?
Hebben gassen en vloeistoffen dezelfde samendrukbaarheidseigenschap?  Kunnen elektriciteitproducerende bacteriën toekomstige ruimtemissies helpen aandrijven?
Kunnen elektriciteitproducerende bacteriën toekomstige ruimtemissies helpen aandrijven?  Wanneer een gloeilamp verlichte elektrische energie wordt gewijzigd en wat gebeurt er?
Wanneer een gloeilamp verlichte elektrische energie wordt gewijzigd en wat gebeurt er?  Waarom worden Europeanen – inclusief jongeren – naar extreemrechts geduwd?
Waarom worden Europeanen – inclusief jongeren – naar extreemrechts geduwd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

