
Wetenschap
Wat zijn moleculaire verbindingen?
Moleculaire verbindingen:een snelle uitleg
Moleculaire verbindingen worden gevormd wanneer twee of meer niet-metalen atomen Deel elektronen om covalente bindingen te creëren . Met dit delen van elektronen kunnen de atomen een stabiele elektronenconfiguratie bereiken, vergelijkbaar met edelgassen.
Hier is een uitsplitsing van sleutelkenmerken:
* gemaakt van niet -metalen: Voorbeelden zijn koolstof (C), zuurstof (O), stikstof (N), chloor (CL), enz.
* Covalente binding: Atomen delen elektronen, breng ze niet over zoals in ionische verbindingen.
* Discrete moleculen: Deze verbindingen bestaan als afzonderlijke, individuele eenheden, vaak met een specifieke geometrische vorm.
* Lagere smelt- en kookpunten: Over het algemeen hebben zwakkere intermoleculaire krachten in vergelijking met ionische verbindingen.
* Meestal niet-geleidend: Leed geen elektriciteit in hun vaste of vloeibare toestanden.
* bestaan vaak als gassen of vloeistoffen bij kamertemperatuur: Vanwege zwakkere intermoleculaire krachten.
Voorbeelden van moleculaire verbindingen:
* Water (H2O): Twee waterstofatomen delen elektronen met één zuurstofatoom.
* koolstofdioxide (CO2): Eén koolstofatoom deelt elektronen met twee zuurstofatomen.
* methaan (CH4): Eén koolstofatoom deelt elektronen met vier waterstofatomen.
* Sugar (C12H22O11): Een complex molecuul met meerdere covalente bindingen.
In tegenstelling tot ionische verbindingen:
* Ionische verbindingen vormen zich uit de elektrostatische aantrekkingskracht tussen tegengesteld geladen ionen, meestal met een metaal en een niet-metaal.
* Ze hebben hoge smelt- en kookpunten, zijn vaak kristallijne vaste stoffen en kunnen elektriciteit leiden wanneer opgelost in water.
Inzicht in het verschil tussen ionische en moleculaire verbindingen is cruciaal in de chemie, waardoor u hun eigenschappen en reacties kunt voorspellen.
 Welke elementen hebben ionen met een -3 lading?
Welke elementen hebben ionen met een -3 lading?  Wat wordt gevormd in de atmosfeer wanneer chemicaliën die vluchtige organische verbinding worden genoemd en stikstofdioxide worden uitgevoerd door zonlicht?
Wat wordt gevormd in de atmosfeer wanneer chemicaliën die vluchtige organische verbinding worden genoemd en stikstofdioxide worden uitgevoerd door zonlicht?  Vormen stikstof en zwavel een ionische verbinding?
Vormen stikstof en zwavel een ionische verbinding?  Hoeveel valentie -elektron zijn er nodig om een atoom stabiel te hebben?
Hoeveel valentie -elektron zijn er nodig om een atoom stabiel te hebben?  Onderschatte chemische diversiteit
Onderschatte chemische diversiteit
 Maak een lijst van de top 5 van natuurlijke hulpbronnen
Maak een lijst van de top 5 van natuurlijke hulpbronnen Wat kunt u afleiden over de kenmerken van pionierplanten?
Wat kunt u afleiden over de kenmerken van pionierplanten?  Waarom is het belangrijk om naar meer dan één bron te kijken wanneer u een wetenschappelijk probleem onderzoekt?
Waarom is het belangrijk om naar meer dan één bron te kijken wanneer u een wetenschappelijk probleem onderzoekt?  Hoe de eenvoudige mestkever betere ecosystemen in Australië creëert
Hoe de eenvoudige mestkever betere ecosystemen in Australië creëert  Microplastics gevonden in Antarctische ijskernen
Microplastics gevonden in Antarctische ijskernen
Hoofdlijnen
- Uit onderzoek blijkt dat er minder invasieve uitheemse soorten voorkomen op het land van inheemse volkeren
- In welke fase van meiose 2 verdeelt het cytoplasma?
- Hoe medische scholen via gemeenschapsverbindingen meer verantwoording kunnen afleggen aan de samenleving
- Welke structuur in levende organismen is gemaakt van fosfolipiden?
- Welke stap komt alvorens een experiment uit te voeren in de wetenschappelijke methode.
- Update over bedreigde Filippijnse cycadsoorten
- Antwoorden op miniatuurfabrieken Een analoge celstructuur en -functie begrijpen?
- Wat zit er eigenlijk in vapes? We hebben ze uit elkaar gehaald om erachter te komen
- Nieuwe analyse van oude vissen kan verklaren hoe de schouder is geëvolueerd
- Geabsorbeerde fotonen door 2-oxocarbonzuren omzetten in zeer reactieve singlet-zuurstof
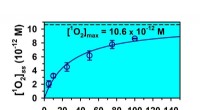
- Het minimaliseren van brandstofexplosies en branden door ongelukken en terroristische daden met polymeren

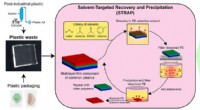
- Nieuw recyclingproces op basis van oplosmiddelen kan miljoenen tonnen plastic afval verminderen
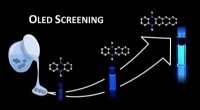
- Moleculaire bibliotheken voor organische lichtemitterende diodes
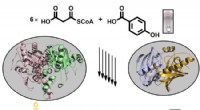
- Biosynthese van wijdverspreide pigmenten van bacteriën onthuld
 Wie stelde voor dat elektronen in bepaalde paden reizen?
Wie stelde voor dat elektronen in bepaalde paden reizen?  Is een mesverbindingsmachine of een eenvoudige machine?
Is een mesverbindingsmachine of een eenvoudige machine?  Het beëindigen van het verlof zal oudere werknemers hard treffen:hoe kunnen we de klap verzachten?
Het beëindigen van het verlof zal oudere werknemers hard treffen:hoe kunnen we de klap verzachten?  Reageren zuren met metalen om water te vormen?
Reageren zuren met metalen om water te vormen?  Als we een Doppler -blauwe verschuiving van Star observeren, moet de dan een?
Als we een Doppler -blauwe verschuiving van Star observeren, moet de dan een?  Welke rol speelt massa en zwaartekracht in de energie die een object heeft?
Welke rol speelt massa en zwaartekracht in de energie die een object heeft?  Hoe orbitale diagrammen te doen
Hoe orbitale diagrammen te doen  Wat is de elektronenconfiguratie van Iron II?
Wat is de elektronenconfiguratie van Iron II?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

